��Ŀ����
����Ŀ��A��E����ѧ������5�ֻ����A��B�����������֮���ת����ϵ��ͼ��ʾ��������˵����ȷ���ǣ� ��
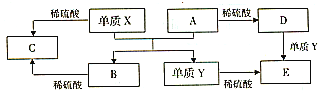
A��x��A��Ӧ�Ļ�ѧ����ʽ�ǣ�Al2O3+2Fe![]() Fe2O3+2Al
Fe2O3+2Al
B������D��Һ�еĽ��������ӵķ�Ӧ��Fe3++3SCN��=Fe��SCN��3��
C������Y��һ������������ˮ�����û���Ӧ
D�����ڻ�����B��C���������ᷴӦ��������Ӧ�����Ծ������Ի�����
���𰸡�C
���������⣺����ת����ϵ������A+X=B+Y���û���Ӧ������XY����ϡ���ᷴӦ��˵���ǽ������ʣ�AB������������ᷴӦ������A�����ᷴӦ���ɵ�D�͵���Y��Ӧ����E��˵��A��Ԫ�ػ��ϼ��DZ�ۣ��ۺϷ����жϣ��û���Ӧ�����ȷ�Ӧ���û���Ӧ�������ж�XΪAl��YΪFe��AΪFe2O3��BΪAl2O3��CΪAl2��SO4��3��DΪFe2��SO4��3��EΪFeSO4��
A��x��A��Ӧ�Ļ�ѧ����ʽ�ǣ�Fe2O3+2Al![]() Al2O3+2Fe����A����
Al2O3+2Fe����A����
B������D��Һ�еĽ���������Ϊ���������ӷ�����Ӧ���ɵIJ��dz�����Fe3++3SCN��=Fe��SCN��3����B����
C������YΪFe���ڸ�������������ˮ���������û���Ӧ��������������������������C��ȷ��
D�����ڻ�����BΪAl2O3�������ᷴӦ��������Ӧ�����������Ի����CΪAl2��SO4��3���β��������ԣ���D����
��ѡC��
