��Ŀ����
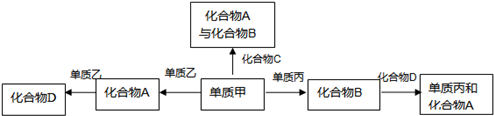
��֪������A��B��D��������Ԫ����ɣ�C�ǹ�����õ���Ҫ����ס��ҡ�����ǰ������Ԫ�ص����ֵ��ʣ���Щ�����Ļ������뵥��֮��������¹�ϵ���ش��������⣺

��1��������A�ĵ���ʽΪ______��������C�Ľṹ��ʽ______��
��2����֪�����²��1g C��ȫȼ�տɷų�15.6kJ��������C��ȫȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��______��
��3������˵����ȷ����______��
A���������漰�Ļ��������������ǵ���ʡ���B��ͼ�����ת����ϵ���������ǻ��Ϸ�Ӧ
C���������漰�Ļ�����ľ�����Ƿ��Ӿ��塡D��ͼ�����ת����ϵ��Ϊ������ԭ��Ӧ
��4���üס������ҡ�������Һ���Թ���һԭ��أ���缫���Ͽ���Ϊ______�������ĵ缫��ӦʽΪ______��
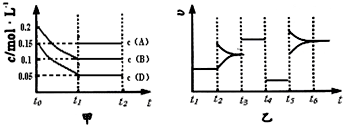
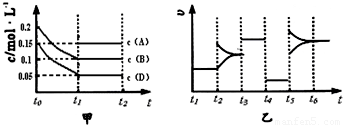
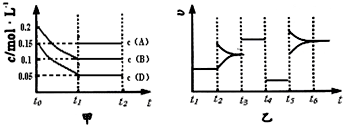
����ij�ܱ������м��� 0.4mol B��0.3mol D��һ������A�������壮һ�������·�����Ӧ��������Ũ����ʱ��ı仯����ͼ�м�ͼ��ʾ����ͼΪ t2ʱ�̺�ı�������������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ������������������ͬ����֪t3��t4��Ϊʹ�ô���[��֪ t0��t1�� c �� A��δ����]��
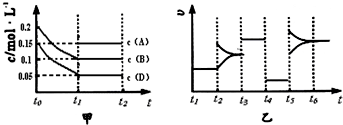 ��1��A����ʼ���ʵ���Ϊ______��
��1��A����ʼ���ʵ���Ϊ______��
��2���������µĻ�ѧƽ�ⳣ��Ϊ______��
��3��t4��t5�θı������Ϊ______��
�⣺�����û���Ӧ�ĸ��������Ҫע������û���Ӧ�ĸ������ͣ��ס��ҡ�����ǰ������Ԫ�ص����ֵ��ʣ�ӦΪ��������̼�������������������е����֣����ݿ�ͼ��Ҫ����ѡ����ʵ����ʣ����Ͽ�ͼ�ĸ������ʿ����ǣ�AΪ������̼��CO2����BΪˮ��H2O����C�ǹ�����õ���Ҫ����ж�CΪC6H12O6��DΪһ����̼��CO��������������O2��������̼��C��������������H2����
��1��������A�Ƕ�����̼�����ӵĵ���ʽΪ��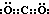 ��������CΪ�����ǣ��ṹ��ʽΪ��CH2OH��CHOH��4CHO���ʴ�Ϊ��
��������CΪ�����ǣ��ṹ��ʽΪ��CH2OH��CHOH��4CHO���ʴ�Ϊ��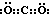 ��CH2OH��CHOH��4CHO��
��CH2OH��CHOH��4CHO��
��2�������²��1g C��C6H12O6����ȫȼ�տɷų�15.6kJ������1mol��������ȫȼ�շ���Ϊ2808KJ����C��ȫȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
C6H12O6��s��+6O2��g���T6CO2��g��+6H2O��l������H=-2808 kJ/mol��
�ʴ�Ϊ��C6H12O6��s��+6O2��g���T6CO2��g��+6H2O��l������H=-2808 kJ/mol��
��3��A���������漰�Ļ������У�ˮ��һ�ּ����ĵ���ʣ���A����
B�����ת����ϵ�У���+�ҡ�A��A+�ҡ�D����+����B�������ǻ��Ϸ�Ӧ��ͼ�����ת����ϵ���������ǻ��Ϸ�Ӧ����B��ȷ��
C���������漰�Ļ�����ľ����������ǡ�ˮ��������̼��һ����̼���Ƿ��Ӿ��壬��C��ȷ��
D�����ת����ϵ�У������滯�ϼ۵ı仯����Ϊ������ԭ��Ӧ����D��ȷ��
�ʴ�Ϊ��B��C��D��
��4���üף�O2��������H2�����ң�C����������Һ���Թ���һԭ��أ��缫���Ͽ���Ϊʯī�����������������ĵ����������������ӵĵ缫��Ӧ�������Ի����£�����������д��ˮ����ʽ�������ĵ缫��Ӧʽ��O2+4e-+4H+=2H2O���ʴ�Ϊ��ʯī�� O2+4e-+4H+=2H2O��
��1������ͼ�������ʼŨ��Ϊ0.2mol/L����BΪH2O��0.15mol/L����DΪCO��AΪCO2����� 0.4mol B��0.3mol D��һ������A���������֪�������Ϊ2L��ͼ����B����0.2mol��D����0.2mol��A��ƽ�����ʵ���Ϊ0.3mol����A����ʼ��ΪX�����ݻ�ѧƽ������ʽ��ʽ����õ���
H2O+CO=CO2 +H2��
��ʼ����mol�� 0.4 0.3 X 0
�仯����mol��0.2 0.2 0.2 0.2
ƽ������mol��0.2 0.1 0.3 0.2
��A�����ʵ�����x+0.2=0.3
X=0.1mol
��2��ƽ��Ũ�ȷֱ�Ϊ��C��H2O ��=0.1mol/L��C��CO��=0.05mol/L��C��CO2��=0.15mol/L��C��H2��=0.1mol/L��
K=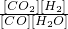 =
= =3
=3
��3��t4��t5�θı����������ͼ�����t4��t5��ƽ�ⲻ�������ʼ�С�����Ըı�������Ǽ�Сѹǿ��
�ʴ�Ϊ����1��0.1mol ��2��3 ��3����Сѹǿ
������I�������û���Ӧ�ĸ��������Ҫע������û���Ӧ�ĸ������ͣ��ס��ҡ�����ǰ������Ԫ�ص����ֵ��ʣ�ӦΪ��������̼�������������������е����֣����ݿ�ͼ��Ҫ����ѡ����ʵ����ʣ����Ͽ�ͼ�ĸ������ʿ����ǣ�AΪ������̼��BΪˮ��C�ǹ�����õ���Ҫ����ж�CΪC6H12O6��DΪһ����̼����������������̼������������
������ͼ�������Ϸ�Ӧ����д����ѧ����ʽ����ϻ�ѧƽ�������ʽ��ʽ���㣬����ƽ�ⳣ��������㣬Ӱ�����ط���ƽ����ƶ���
���������⿼��������ת����ϵ�ķ����жϣ��������ʵ�Ӧ�ã��Ȼ�ѧ����ʽ��Ӧ�ã�����ʽ����д��ԭ���ԭ����Ӧ�ã���ѧƽ��ļ���Ӧ�ã�ƽ�ⳣ���ļ��㣬����ʱ��ͼ��ķ���������Ӱ��ƽ���������������Ŀ�Ѷ��еȣ�
��1��������A�Ƕ�����̼�����ӵĵ���ʽΪ��
 ��������CΪ�����ǣ��ṹ��ʽΪ��CH2OH��CHOH��4CHO���ʴ�Ϊ��
��������CΪ�����ǣ��ṹ��ʽΪ��CH2OH��CHOH��4CHO���ʴ�Ϊ��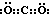 ��CH2OH��CHOH��4CHO��
��CH2OH��CHOH��4CHO����2�������²��1g C��C6H12O6����ȫȼ�տɷų�15.6kJ������1mol��������ȫȼ�շ���Ϊ2808KJ����C��ȫȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
C6H12O6��s��+6O2��g���T6CO2��g��+6H2O��l������H=-2808 kJ/mol��
�ʴ�Ϊ��C6H12O6��s��+6O2��g���T6CO2��g��+6H2O��l������H=-2808 kJ/mol��
��3��A���������漰�Ļ������У�ˮ��һ�ּ����ĵ���ʣ���A����
B�����ת����ϵ�У���+�ҡ�A��A+�ҡ�D����+����B�������ǻ��Ϸ�Ӧ��ͼ�����ת����ϵ���������ǻ��Ϸ�Ӧ����B��ȷ��
C���������漰�Ļ�����ľ����������ǡ�ˮ��������̼��һ����̼���Ƿ��Ӿ��壬��C��ȷ��
D�����ת����ϵ�У������滯�ϼ۵ı仯����Ϊ������ԭ��Ӧ����D��ȷ��
�ʴ�Ϊ��B��C��D��
��4���üף�O2��������H2�����ң�C����������Һ���Թ���һԭ��أ��缫���Ͽ���Ϊʯī�����������������ĵ����������������ӵĵ缫��Ӧ�������Ի����£�����������д��ˮ����ʽ�������ĵ缫��Ӧʽ��O2+4e-+4H+=2H2O���ʴ�Ϊ��ʯī�� O2+4e-+4H+=2H2O��
��1������ͼ�������ʼŨ��Ϊ0.2mol/L����BΪH2O��0.15mol/L����DΪCO��AΪCO2����� 0.4mol B��0.3mol D��һ������A���������֪�������Ϊ2L��ͼ����B����0.2mol��D����0.2mol��A��ƽ�����ʵ���Ϊ0.3mol����A����ʼ��ΪX�����ݻ�ѧƽ������ʽ��ʽ����õ���
H2O+CO=CO2 +H2��
��ʼ����mol�� 0.4 0.3 X 0
�仯����mol��0.2 0.2 0.2 0.2
ƽ������mol��0.2 0.1 0.3 0.2
��A�����ʵ�����x+0.2=0.3
X=0.1mol
��2��ƽ��Ũ�ȷֱ�Ϊ��C��H2O ��=0.1mol/L��C��CO��=0.05mol/L��C��CO2��=0.15mol/L��C��H2��=0.1mol/L��
K=
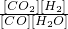 =
= =3
=3��3��t4��t5�θı����������ͼ�����t4��t5��ƽ�ⲻ�������ʼ�С�����Ըı�������Ǽ�Сѹǿ��
�ʴ�Ϊ����1��0.1mol ��2��3 ��3����Сѹǿ
������I�������û���Ӧ�ĸ��������Ҫע������û���Ӧ�ĸ������ͣ��ס��ҡ�����ǰ������Ԫ�ص����ֵ��ʣ�ӦΪ��������̼�������������������е����֣����ݿ�ͼ��Ҫ����ѡ����ʵ����ʣ����Ͽ�ͼ�ĸ������ʿ����ǣ�AΪ������̼��BΪˮ��C�ǹ�����õ���Ҫ����ж�CΪC6H12O6��DΪһ����̼����������������̼������������
������ͼ�������Ϸ�Ӧ����д����ѧ����ʽ����ϻ�ѧƽ�������ʽ��ʽ���㣬����ƽ�ⳣ��������㣬Ӱ�����ط���ƽ����ƶ���
���������⿼��������ת����ϵ�ķ����жϣ��������ʵ�Ӧ�ã��Ȼ�ѧ����ʽ��Ӧ�ã�����ʽ����д��ԭ���ԭ����Ӧ�ã���ѧƽ��ļ���Ӧ�ã�ƽ�ⳣ���ļ��㣬����ʱ��ͼ��ķ���������Ӱ��ƽ���������������Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ

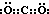
 ��1��A����ʼ���ʵ���Ϊ
��1��A����ʼ���ʵ���Ϊ