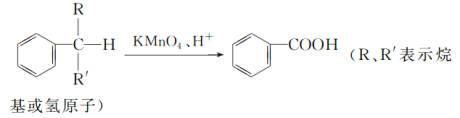
题目内容
【题目】由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
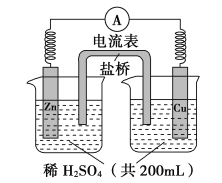
(1)原电池的负极反应是______________________,
正极反应是__________________________。
(2)电流的方向是_____________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗________g锌,有____________个电子通过了导线,原硫酸的物质的量浓度是_____________(设溶液体积不变)。
【答案】(1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)由Cu极流向Zn极
(3)4.875 9.03×1022 0.75 mol·L-1
【解析】产生0.075 mol H2,通过0.075 mol×2=0.15 mol电子,消耗0.075 mol Zn和0.075 mol H2SO4。所以m(Zn)=0.075 mol×65 g·mol-1=4.875 g,N(e-)=0.15 mol×6.02×1023 mol-1=9.03×1022,c(H2SO4)=![]() =0.75 mol·L-1。
=0.75 mol·L-1。

 口算能手系列答案
口算能手系列答案【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。