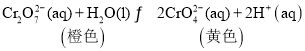题目内容
【题目】已知A为金属单质,如图所示流程中的各步反应的最后生成物E是白色沉淀。

(1)请写出其化学式:A________、C__________。
(2)写出下列各步反应的离子方程式。
②_______________________;④________________________;⑤________________________。
【答案】Al NaAlO2 2Al+2OH-+2H2O=2![]() +3H2↑ Al3++3NH3·H2O===Al(OH)3↓+3
+3H2↑ Al3++3NH3·H2O===Al(OH)3↓+3![]()
![]() +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+![]()
【解析】
根据题中各物质转化关系,A为金属单质,能与氢氧化钠反应的金属只有单质Al;C又与过量的二氧化碳反应生成E,可以确定A为Al,结合图中各物质反应条件可推知D为Al2(SO4)3,C为NaAlO2,E为Al(OH)3,B为AlCl3;铝和氯气反应生成氯化铝,铝和氢氧化钠反应生成偏铝酸钠和氢气,铝和稀硫酸的置换反应,反应④氯化铝与氨水反应生成氢氧化铝,偏铝钠与过量二氧化碳反应生成氢氧化铝和碳酸氢钠,硫酸铝与氨水反应生成氢氧化铝沉淀,据此分析。
根据题中各物质转化关系,A为金属单质,能与氢氧化钠反应生成C,C又与过量的二氧化碳反应生成E,可以确定A为Al,结合图中各物质反应条件可推知D为Al2(SO4)3,C为NaAlO2,E为Al(OH)3,B为AlCl3;铝和氯气反应生成氯化铝,铝和氢氧化钠反应生成偏铝酸钠和氢气,铝和稀硫酸的置换反应,反应④氯化铝与氨水反应生成氢氧化铝,偏铝钠与过量二氧化碳反应生成氢氧化铝和碳酸氢钠,硫酸铝与氨水反应生成氢氧化铝沉淀;
(1)根据上面的分析可知,A为Al,C为NaAlO2;
综上所述,本题答案是:Al,NaAlO2;
(2)反应②为铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
反应④氯化铝与氨水反应生成氢氧化铝和氯化铵,反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+;
反应⑤偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-。
综上所述,本题答案是:2Al+2OH-+2H2O═2AlO2-+3H2↑;Al3++3NH3H2O=Al(OH)3↓+3NH4+;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-。

【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: | |
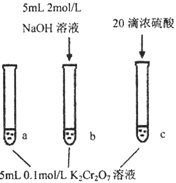
步骤:
| 现象: 待试管b中颜色不变后与试管a比较,溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使![]() 完全反应
完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度