题目内容
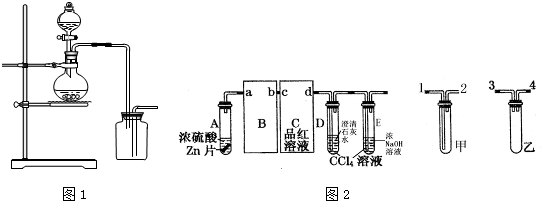
I.如图1是某学生设计的制取和收集某些气体的实验装置(可加热).
(1)该装置在加入反应物前,应首先进行的实验操作是______.
(2)下列气体的制取中,若用排空气法收集,可使用该装置制备和收集的是(选填编号,下同)______若用排水法收集(集气瓶中充满水),可使用该装置制备和收集的是______.
①用Zn与稀盐酸反应制H2
②用CaCO3与稀盐酸反应制CO2
③用固体NaOH和浓氨水制NH3
④用Cu与稀HNO3反应制NO
⑤用MnO2与双氧水反应制O2
⑥浓硫酸与铜片反应制SO2
⑦用MnO2与浓盐酸反应制Cl2
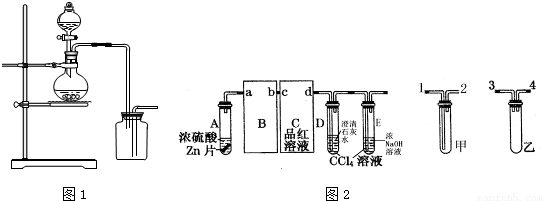
II.某校化学研究性学习小组对浓硫酸与金属锌的反应进行探究.首先按图2组装好实验装置,然后取一定量的浓硫酸与足量Zn充分反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑浊消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加.
试回答:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,该实验中起到同样作用的装置是______;
(3)能证明浓硫酸具有强氧化性的实验现象为______;
(4)反应较长时间后气泡量又会明显增加的原因是______;
(5)D中浑浊消失的离子方程式为______.
解:I、(1)应首先检查装置气密性,故答案为:检查装置气密性;
(2)该装置为固液不加热装置,气体用向下排空气法收集,①③可使用该装置制备和收集;若用排水法收集,生成气体不能溶于水,①④⑤可使用该装置制备和收集,故答案为:①③;①④⑤;
II、(1)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,故答案为:3或4;4或3; 1; 2;(2)乙可防止倒吸,故答案为:乙;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,故答案为:C中品红溶液褪色;
(4)随反应进行浓H2SO4变成稀H2SO4,与Zn反应放出H2,故答案为:浓H2SO4变成稀H2SO4,与Zn反应放出H2;
(5)过量的二氧化硫能使亚硫酸钙溶解,离子方程式为SO2+CaSO3+H2O=Ca2++2HSO3-,故答案为:SO2+CaSO3+H2O=Ca2++2HSO3-.
分析:I、(1)先检查装置气密性;
(2)该装置为固液不加热装置,气体用向下排空气法收集;若用排水法收集,生成气体不能溶于水;
II、(1)B的作用是防止倒吸;C装置的作用是检验二氧化硫的漂白性,可用洗气装置; (2)乙可防止倒吸;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性;
(4)随反应进行浓H2SO4变成稀H2SO4;
(5)过量的二氧化硫能使亚硫酸钙溶解.
点评:本题考查常见气体制备原理及装置选择,难度适中,注意实验装置的选择.
(2)该装置为固液不加热装置,气体用向下排空气法收集,①③可使用该装置制备和收集;若用排水法收集,生成气体不能溶于水,①④⑤可使用该装置制备和收集,故答案为:①③;①④⑤;
II、(1)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,故答案为:3或4;4或3; 1; 2;(2)乙可防止倒吸,故答案为:乙;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,故答案为:C中品红溶液褪色;
(4)随反应进行浓H2SO4变成稀H2SO4,与Zn反应放出H2,故答案为:浓H2SO4变成稀H2SO4,与Zn反应放出H2;
(5)过量的二氧化硫能使亚硫酸钙溶解,离子方程式为SO2+CaSO3+H2O=Ca2++2HSO3-,故答案为:SO2+CaSO3+H2O=Ca2++2HSO3-.
分析:I、(1)先检查装置气密性;
(2)该装置为固液不加热装置,气体用向下排空气法收集;若用排水法收集,生成气体不能溶于水;
II、(1)B的作用是防止倒吸;C装置的作用是检验二氧化硫的漂白性,可用洗气装置; (2)乙可防止倒吸;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性;
(4)随反应进行浓H2SO4变成稀H2SO4;
(5)过量的二氧化硫能使亚硫酸钙溶解.
点评:本题考查常见气体制备原理及装置选择,难度适中,注意实验装置的选择.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目