题目内容
(2011?福建模拟)某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S.下列说法正确的是( )
分析:CuFeS2中Cu、Fe的化合价都为+2价,S元素的化合价为-2价,反应CuFeS2+4Fe3+=5Fe2++Cu2++2S中,S元素化合价升高,Fe元素化合价降低,从化合价变化的角度分析氧化还原反应.
解答:解:A.反应CuFeS2+4Fe3+=5Fe2++Cu2++2S中,S元素化合价升高,Fe元素化合价降低,氧化剂为Fe3+,还原剂为CuFeS2,故A错误;
B.氧化产物是S,还原产物是Fe2+,Cu元素化合价没有变化,故B错误;
C.n(CuFeS2)=
=0.25mol,转移电子的物质的量为0.25mol×2×(2-0)=1mol,故C正确;
D.根据反应Fe+Cu2+=Fe2++Cu,可知氧化性Cu2+>Fe2+,故D错误.
故选C.
B.氧化产物是S,还原产物是Fe2+,Cu元素化合价没有变化,故B错误;
C.n(CuFeS2)=
| 46g |
| 184g/mol |
D.根据反应Fe+Cu2+=Fe2++Cu,可知氧化性Cu2+>Fe2+,故D错误.
故选C.
点评:本题考查氧化还原反应知识,题目难度不大,本题注意把握氧化还原反应的判断角度,注意化合价的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )
(2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )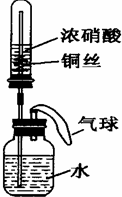 (2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )
(2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )