题目内容
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能.请按照要求完成下列方程式.Ⅰ,生活中很多现象和原理都可以用化学反应来解释:
(1)写出 泡沫灭火器反应原理的离子方程式:______.
(2)氨气是重要的化工原料,请写出 实验室制氨气 的反应方程式:______ CaCl2+2NH3↑+2H2O
【答案】分析:Ⅰ、(1)泡沫灭火器反应原理是硫酸铝和碳酸氢钠溶液混合产生二氧化碳的反应;
(2)实验室制取氨气是用氢氧化钙和氯化铵固体加热反应生成;
Ⅱ依据氧化还原反应的化合价升降,判断产生的物质,依据原子守恒、电子守恒分析判断;
Ⅲ、①两种弱酸溶液混合反应后,溶液的酸性减弱,依据所学弱酸混合发生氧化还原反应书写;
②一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸,反应生成产物中应存在沉淀.
解答:解:Ⅰ、(1)泡沫灭火器反应原理是硫酸铝和碳酸氢钠溶液混合产生二氧化碳和氢氧化铝沉淀,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)实验室制取氨气是用氢氧化钙和氯化铵固体加热反应生成,反应的离子方程式为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2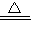 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
Ⅱ、一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O,硝酸做氧化剂被还原为N2O,能做还原剂的化合价升高,FeSO4被氧化为硫酸铁
硝酸铁,依据氧化还原反应的电子守恒和反应的原子守恒书写配平化学方程式:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O;
Ⅲ①两种弱酸溶液混合反应后,溶液的酸性减弱,依据所学弱酸混合发生氧化还原反应:还原性酸为H2S,氧化性弱酸为H2SO3;化学方程式为:2H2S+H2SO3=3S↓+3H2O,
故答案为:2H2S+H2SO3=3S↓+3H2O;
②一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸,依据复分解反应条件分析:硫酸铜和氢硫酸反应生成硫化铜沉淀,难溶于强酸,反应的离子方程式为Cu2++H2S=CuS↓+2H+,故答案为:Cu2++H2S=CuS↓+2H+.
点评:本题考查了泡沫灭火器的反应原理,实验室制氨气的原理,氧化还原反应的化合价升降,电子守恒的应用,常见物质性质的反应应用,主要是化学方程式、离子方程式的书写.
(2)实验室制取氨气是用氢氧化钙和氯化铵固体加热反应生成;
Ⅱ依据氧化还原反应的化合价升降,判断产生的物质,依据原子守恒、电子守恒分析判断;
Ⅲ、①两种弱酸溶液混合反应后,溶液的酸性减弱,依据所学弱酸混合发生氧化还原反应书写;
②一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸,反应生成产物中应存在沉淀.
解答:解:Ⅰ、(1)泡沫灭火器反应原理是硫酸铝和碳酸氢钠溶液混合产生二氧化碳和氢氧化铝沉淀,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)实验室制取氨气是用氢氧化钙和氯化铵固体加热反应生成,反应的离子方程式为:2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
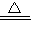 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;Ⅱ、一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O,硝酸做氧化剂被还原为N2O,能做还原剂的化合价升高,FeSO4被氧化为硫酸铁
硝酸铁,依据氧化还原反应的电子守恒和反应的原子守恒书写配平化学方程式:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O;
Ⅲ①两种弱酸溶液混合反应后,溶液的酸性减弱,依据所学弱酸混合发生氧化还原反应:还原性酸为H2S,氧化性弱酸为H2SO3;化学方程式为:2H2S+H2SO3=3S↓+3H2O,
故答案为:2H2S+H2SO3=3S↓+3H2O;
②一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸,依据复分解反应条件分析:硫酸铜和氢硫酸反应生成硫化铜沉淀,难溶于强酸,反应的离子方程式为Cu2++H2S=CuS↓+2H+,故答案为:Cu2++H2S=CuS↓+2H+.
点评:本题考查了泡沫灭火器的反应原理,实验室制氨气的原理,氧化还原反应的化合价升降,电子守恒的应用,常见物质性质的反应应用,主要是化学方程式、离子方程式的书写.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目