题目内容
(1)标准状况是指:温度为______℃,压强为______Pa.
(2)NH3的摩尔质量是______,0.5mol NH3的质量是______,其中含有NH3的分子数目是______,含有H原子数目是______,在标准状况下的体积约为______,溶于水形成500ml溶液,该溶液的物质的量浓度为______.
(3)4.5g水与______g硫酸所含的物质的量相等,其中氢原子数之比是______.
(4)配制250mL 1mol?L-1HCl溶液,需要5mol?L-1 HCl溶液的体积是______ mL.
解:(1)标准状况是指:0℃,101KPa的条件,故答案为:0;1.01×105;
(2)摩尔质量在数值上等于相对分子质量,NH3的摩尔质量是17g/mol,m=n?M=0.5mol×17g/mol=8.5g,,分子数N=nNA=0.5molNA,氨气中H原子数目是分子数目的3倍,即为1.5NA,V=nVm=0.5mol×22.4L/mol=11.2L,c= =
=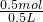 =1 mol/L,故答案为:17 g?mol-1;8.5g;0.5NA;1.5NA;11.2L;1 mol/L;
=1 mol/L,故答案为:17 g?mol-1;8.5g;0.5NA;1.5NA;11.2L;1 mol/L;
(3)4.5g水的物质的量n= =
=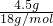 =0.25mol,0.25mol硫酸的质量m=nM=0.25mol×98g/mol=24.5g,0.25mol的水中含有氢原子为0.5mol,0.25mol的硫酸中含有氢原子为0.5mol,所以氢原子数之比是1:1,故答案为:24.5g;1:1;
=0.25mol,0.25mol硫酸的质量m=nM=0.25mol×98g/mol=24.5g,0.25mol的水中含有氢原子为0.5mol,0.25mol的硫酸中含有氢原子为0.5mol,所以氢原子数之比是1:1,故答案为:24.5g;1:1;
(4)溶液稀释前后溶质的物质的量保持不变,设需要5mol?L-1 HCl溶液的体积是V,则0.250L×1mol?L-1=5mol?L-1?V,解得V=0.05L=50mL,故答案为:50.
分析:(1)标准状况是指:0℃,101KPa的条件;
(2)摩尔质量在数值上等于相对分子质量,m=n?M,分子数N=nNA,氨气中H原子数目是分子数目的3倍,据V=nVm来计算体积,据c= 来计算浓度.
来计算浓度.
(3)据n= 来计算物质的量,根据分子的原子构成来计算原子数之比;
来计算物质的量,根据分子的原子构成来计算原子数之比;
(4)根据溶液稀释前后溶质的物质的量保持不变来计算.
点评:本题是一道有关物质的量的计算题,注意物质的量是沟通宏观量和微观量的桥梁,在解题过程中非常重要.
(2)摩尔质量在数值上等于相对分子质量,NH3的摩尔质量是17g/mol,m=n?M=0.5mol×17g/mol=8.5g,,分子数N=nNA=0.5molNA,氨气中H原子数目是分子数目的3倍,即为1.5NA,V=nVm=0.5mol×22.4L/mol=11.2L,c=
 =
=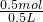 =1 mol/L,故答案为:17 g?mol-1;8.5g;0.5NA;1.5NA;11.2L;1 mol/L;
=1 mol/L,故答案为:17 g?mol-1;8.5g;0.5NA;1.5NA;11.2L;1 mol/L;(3)4.5g水的物质的量n=
 =
=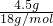 =0.25mol,0.25mol硫酸的质量m=nM=0.25mol×98g/mol=24.5g,0.25mol的水中含有氢原子为0.5mol,0.25mol的硫酸中含有氢原子为0.5mol,所以氢原子数之比是1:1,故答案为:24.5g;1:1;
=0.25mol,0.25mol硫酸的质量m=nM=0.25mol×98g/mol=24.5g,0.25mol的水中含有氢原子为0.5mol,0.25mol的硫酸中含有氢原子为0.5mol,所以氢原子数之比是1:1,故答案为:24.5g;1:1;(4)溶液稀释前后溶质的物质的量保持不变,设需要5mol?L-1 HCl溶液的体积是V,则0.250L×1mol?L-1=5mol?L-1?V,解得V=0.05L=50mL,故答案为:50.
分析:(1)标准状况是指:0℃,101KPa的条件;
(2)摩尔质量在数值上等于相对分子质量,m=n?M,分子数N=nNA,氨气中H原子数目是分子数目的3倍,据V=nVm来计算体积,据c=
 来计算浓度.
来计算浓度.(3)据n=
 来计算物质的量,根据分子的原子构成来计算原子数之比;
来计算物质的量,根据分子的原子构成来计算原子数之比;(4)根据溶液稀释前后溶质的物质的量保持不变来计算.
点评:本题是一道有关物质的量的计算题,注意物质的量是沟通宏观量和微观量的桥梁,在解题过程中非常重要.

练习册系列答案
相关题目