��Ŀ����
 ��1����ˮ����ͨ�����ȵĽ�̿���ɲ���ˮú������ӦΪ��C��s��+H2O��g��?CO��g��+H2��g��һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ�����в����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����
��1����ˮ����ͨ�����ȵĽ�̿���ɲ���ˮú������ӦΪ��C��s��+H2O��g��?CO��g��+H2��g��һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ�����в����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����a��d
a��d
������ĸ����ͬ����a�������е�ѹǿ����
b��1mol H-H�����ѵ�ͬʱ����2molH-O��
c��v����CO��=v����H2O��
d��c��CO��=c��H2��
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��
CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.16mol?��L?min��-1
0.16mol?��L?min��-1
���ڸ÷�ӦΪ
����
����
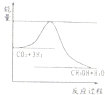
������ȡ����ȡ�����Ӧ��3����ͼ��ʾ��ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g�����й�������������λΪkJ?mol-1���ı仯�������Ϊ1L�ĺ����ܱ������У�����1molCO2��3molH2�����д�ʩ����ʹcCH3OH���������
c��d
c��d
��a�������¶�
b������H2��g����ʹ��ϵѹǿ����
c����H2O��g������ϵ�з������
d���ٳ���1molCO2��3molH2��
��������1�����ݻ�ѧƽ��״̬�������жϣ�
��2���ٸ������ʼ��㹫ʽ���м��㣻
�ڸ����¶ȱ仯��ƽ��ʱ������������ʵ����Ķ����ж�ƽ���ƶ��ķ���
��3��ʹc ��CH3OH������Ӧʹƽ��������Ӧ�����ƶ���
��2���ٸ������ʼ��㹫ʽ���м��㣻
�ڸ����¶ȱ仯��ƽ��ʱ������������ʵ����Ķ����ж�ƽ���ƶ��ķ���
��3��ʹc ��CH3OH������Ӧʹƽ��������Ӧ�����ƶ���
����⣺��1��a����Ӧǰ�������������䣬�����Ƿ�ﵽƽ��״̬�������е�ѹǿ�����䣬��a��ȷ��
b��1molH-H�����ѵ�ͬʱ����2molH-O����˵�����淴Ӧ������ȣ��ﵽƽ��״̬����b����
c��v����CO��=v����H2O����˵�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����c����
d��c��CO��=c��H2������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��ƽ��ʱ�����ʵ�Ũ��ȡ���ڷ�Ӧ������ϱȺ�ת���ij̶ȣ���d��ȷ��
�ʴ�Ϊ��a��d��
��2���٣���v��CO2��=v��CO��=
=0.16mol?��L?min��-1��
�ʴ�Ϊ��0.16mol?��L?min��-1��
�ڸ���CO��g��+H2O��g��?CO2��g��+H2��g����֪ѹǿ��ƽ���ƶ���Ӱ�죬�����650�棬H2O��CO�����ʵ�����Ϊ1mol��2mol���ﵽƽ��ʱCO�����ʵ���ӦΪ1.2mol����900��ʱCO�����ʵ���ӦΪ1.6mol��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ��ǣ����ȣ�
��3��a�������¶�ƽ�����淴Ӧ�����ƶ���CH3OH��С����a����
b������He��g����ʹ��ϵѹǿ����ƽ��û���ƶ�����b����
c����H2O��g������ϵ�з��������ƽ��������Ӧ�����ƶ���CH3OHŨ������c��ȷ��
d���ٳ���1mol CO2��3mol H2��ƽ��������Ӧ�����ƶ���CH3OHŨ������d��ȷ��
�ʴ�Ϊ��c��d��
b��1molH-H�����ѵ�ͬʱ����2molH-O����˵�����淴Ӧ������ȣ��ﵽƽ��״̬����b����
c��v����CO��=v����H2O����˵�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����c����
d��c��CO��=c��H2������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��ƽ��ʱ�����ʵ�Ũ��ȡ���ڷ�Ӧ������ϱȺ�ת���ij̶ȣ���d��ȷ��
�ʴ�Ϊ��a��d��
��2���٣���v��CO2��=v��CO��=
| ||
| 5min |
�ʴ�Ϊ��0.16mol?��L?min��-1��
�ڸ���CO��g��+H2O��g��?CO2��g��+H2��g����֪ѹǿ��ƽ���ƶ���Ӱ�죬�����650�棬H2O��CO�����ʵ�����Ϊ1mol��2mol���ﵽƽ��ʱCO�����ʵ���ӦΪ1.2mol����900��ʱCO�����ʵ���ӦΪ1.6mol��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ��ǣ����ȣ�
��3��a�������¶�ƽ�����淴Ӧ�����ƶ���CH3OH��С����a����
b������He��g����ʹ��ϵѹǿ����ƽ��û���ƶ�����b����
c����H2O��g������ϵ�з��������ƽ��������Ӧ�����ƶ���CH3OHŨ������c��ȷ��
d���ٳ���1mol CO2��3mol H2��ƽ��������Ӧ�����ƶ���CH3OHŨ������d��ȷ��
�ʴ�Ϊ��c��d��
���������⿼�黯ѧƽ������Լ���ѧƽ���ƶ������⣬��Ŀ�Ѷ��еȣ�����ע�⣨2��Ϊ�״��㣬ע����յ�Чƽ������⣮

��ϰ��ϵ�д�
�����Ŀ