题目内容
4.现有A、B两种链状饱和一元醇的混合物0.3mol,其质量为13.8g.已知A和B碳原子数均不大于4,且A<B.(1)混合物中A可能的分子式CH4O;B可能的分子式C3H8O或C4H10O.
(2)若n(A):n(B)=1:1时,A的名称甲醇;B的名称1-丙醇或2-丙醇.
(3)若n(A):n(B)≠1:1时,A的结构简式为CH3OH;则n(A):n(B)=2:1.
分析 (1)链状饱和一元醇的组成通式为CnH2n+2O,A、B两种链状饱和一元醇的混合物的平均相对分子质量为$\frac{13.8}{0.3}$=46,乙醇的相对分子质量为46,故一定含有甲醇,A和B碳原子数均不大于4,且A<B,故A为甲醇,则B为C3H8O或C4H10O;
(2)A为甲醇,根据平均相对分子质量,计算B的相对分子质量,再根据组成通式计算B的组成,据此进行命名;
(3)A为甲醇,n(A):n(B)≠1:1时,则B的分子式与(2)中B的分子式不同,判断B的结构,设1 mol混合物中CH3OH物质的量为x,则B为(1mol-x),列方程计算x的值,据此计算n(A):n(B).
解答 解:(1)链状饱和一元醇的组成通式为CnH2n+2O,A、B两种链状饱和一元醇的混合物的平均相对分子质量为$\frac{4.6}{0.1}$=46,乙醇的相对分子质量为46,故一定含有甲醇,A和B碳原子数均不大于4,且A<B,故A为CH3OH,B为C3H8O或C4H10O,
故答案为:CH4O; C3H8O或C4H10O;
(2)若n(A):n(B)=1:1时,A为CH3OH,令B的相对分子质量为x,则:$\frac{x+32}{1+1}$=46,解得x=60,故B为C3H8O,B为1-丙醇或2-丙醇.
故答案为:甲醇;1-丙醇或2-丙醇;
(3)若n(A):n(B)≠1:1时,A为CH3OH,B为C4H10O,
设1 mol混合物中CH3OH物质的量为x,则C4H10O为(1 mol-x),由于CH3OH相对分子质量为32,C4H10O相对分子质量为74,则:32 g•mol-1•x+74 g•mol-1•(1 mol-x)=46 g,解得x=$\frac{2}{3}$mol,所以1 mol-x=$\frac{1}{3}$mol,故n(A):n(B)=$\frac{2}{3}$mol:$\frac{1}{3}$mol=2:1.
故答案为:CH3OH;2:1.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,注意分子式的确定、有机物的结构与性质等,难度中等,利用平均相对分子质量判断一定含有甲醇是解题关键.

 黄冈创优卷系列答案
黄冈创优卷系列答案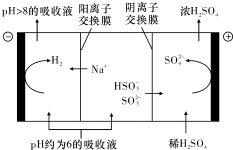 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:HSO${\;}_{3}^{-}$在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
| A. | 负极反应式:Ag+Cl--e-=AgCl | |
| B. | 电子从电源的正极经外电路流向负极 | |
| C. | Cl-不断向“海水”电池的负极移动 | |
| D. | 每生成1molNa2Mn5O10转移2mol电子 |
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1 molA从酸中置换出的H2比1 molB从酸中置换出的氢气多 | |
| D. | 常温时,A能从水中置换出氢气而B不能 |
| A. | Na | B. | Mg | C. | Al | D. | Fe |
 2008年北京残奥会吉祥物是“福牛乐乐”(Fumulele).有一种有机物的键线式也酷似牛.故称为牛式二烯炔醇(eowenynenyno1)
2008年北京残奥会吉祥物是“福牛乐乐”(Fumulele).有一种有机物的键线式也酷似牛.故称为牛式二烯炔醇(eowenynenyno1)