题目内容
向500ml盐酸中投入11.2克铁,二者恰好完全反应(忽略体积变化),计算:
(1)反应后所得溶液的物质的量浓度
(2)生成标准状况下H2的体积。
(1)反应后所得溶液的物质的量浓度
(2)生成标准状况下H2的体积。
(共6分)⑴ c(FeCl2)="0.4" mol/L ⑵ V(H2)=4.48L
试题分析:11.2g铁的物质的量是11.2g÷56g/mol=0.2mol,则根据反应式可知
Fe+2HCl=FeCl2+H2↑
1mol 1mol 22.4L
0.2mol 0.2mol 4.48L
所以反应后所得溶液的物质的量浓度是0.2mol÷0.5L=0.4mol/L
氢气的体积是4.48L
点评:该题是基础性试题的考查,难度不大。试题基础性强,主要是考查学生对以物质的量为核心的有关计算的熟悉掌握程度,有利于培养学生的逻辑推理能力和规范答题能力。该类试题需要注意的是在进行物质的量的有关计算时,关键是熟练应用几个关系式
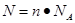 、n=m/M、
、n=m/M、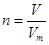 、
、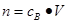 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
练习册系列答案
相关题目