题目内容
14.100.0mL 6.0mol/L H2SO4溶液跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )| A. | Na2CO3溶液 | B. | 水 | C. | CuSO4(aq) | D. | NaHSO4(s) |
分析 反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答.
解答 解:A.加入碳酸钠,与硫酸反应生成二氧化碳,减缓反应速率,硫酸不足,且影响生成氢气的总量,故A不选;
B.加水,氢离子的浓度减小,减缓反应速率,但又不影响生成氢气的总量,故B选;
C.加入硫酸铜,锌置换出铜,形成原电池反应,加快反应速率,故C不选;
D.加入硫酸氢钠,在溶液中电离出氢离子,氢离子浓度增大,则反应速率增大,生成氢气的总量增大,故D不选.
故选B.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于基本概念的综合理解和运用的考查,明确温度、浓度、接触面积对反应速率的影响即可解答,选项D为学生解答中的难点,题目难度不大.

练习册系列答案
相关题目
5. 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )| A. | 曲线上任意一点均存在:c(H+)+c(Na+)═c(OH-)+c(Y2-)+c(HY-) | |
| B. | c(Na+)=0.10 mol•L-1时,溶液中的c(H+)+c(H2Y)═c(OH-)+c(Y2-) | |
| C. | 由图可知,H2Y为二元弱酸,如果将物质的量浓度均为0.20mol•L-1的NaHY和Na2Y溶液等体积混合,所得溶液的pH=4.2 | |
| D. | 已知25℃时,HCOOH的Ka=1×10-4.若把少量H2Y加入到HCOONa溶液中,发生的离子反应可表示为:H2Y+2HCOO-═2HCOOH+Y2- |
2.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2 | ||
| C. |  | D. |  |
9.下列离子方程式中正确的是( )
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++SO42-→BaSO4↓ | |
| B. | 碳酸钙溶于稀硝酸:CO32-+2H+→CO2↑+H2O | |
| C. | 氨水与稀硫酸反应:NH3•H2O+H+→NH4++H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-→H2O |
19.关于硅及其化合物的叙述错误的是( )
| A. | 单质硅是良好的半导体材料 | B. | 光导纤维的主要成分是硅酸盐 | ||
| C. | 硅是构成矿物与岩石的主要元素 | D. | 玻璃、水泥、陶瓷都属于硅酸盐产品 |
6.下列物质属于电解质的是( )
| A. | 金属铜 | B. | 干冰 | C. | 冰醋酸 | D. | 氨气(NH3) |
1. 最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
的物质为研究对象,在环境治理和新能源开发等方面有突出贡献.请回答下列问题:
I.汽车尾气中含有CO和NO,某研究小组利用反应:2CO+2NO?N2+2CO2实现气体的无害化排放.T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如表:
(1)0~2s内用N2表示的化学反应速率为1.875×10-4mol/(L•s),该温度下,反应的平衡常数K1=5000L/mol.
(2)若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1>K2(填“>”、“<”或“=”).
Ⅱ.在一定条件下以CO和H2为原料可以合成重要的化工原料乙二醛(OHC-CHO).
(3)CO和H2合成乙二醛的反应为可逆反应,对应的化学方程式为2CO+H2?OHC-CHO.
(4)乙二醛经催化氧化后可得到乙二酸( H2C2O4),H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.4×10-2,K2=5.4×10-5则Na HC2O4溶液显酸性(填“酸性”、“中性”或“碱性”);
已知常温下NH3•H2O的电离平衡常数K=1.8×10-5,则反应:NH3•H2O+HC2O4-?NH4++C2O42-的化学平衡
常数K=9.72×104.
(5)工业上用“双极室成对电解法”生产乙醛酸(HOOC-CHO),原理如图所示.该装置中阴、阳两极均为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸,该反应的化学方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,N电极的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
 最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子的物质为研究对象,在环境治理和新能源开发等方面有突出贡献.请回答下列问题:
I.汽车尾气中含有CO和NO,某研究小组利用反应:2CO+2NO?N2+2CO2实现气体的无害化排放.T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如表:
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-3mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1>K2(填“>”、“<”或“=”).
Ⅱ.在一定条件下以CO和H2为原料可以合成重要的化工原料乙二醛(OHC-CHO).
(3)CO和H2合成乙二醛的反应为可逆反应,对应的化学方程式为2CO+H2?OHC-CHO.
(4)乙二醛经催化氧化后可得到乙二酸( H2C2O4),H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.4×10-2,K2=5.4×10-5则Na HC2O4溶液显酸性(填“酸性”、“中性”或“碱性”);
已知常温下NH3•H2O的电离平衡常数K=1.8×10-5,则反应:NH3•H2O+HC2O4-?NH4++C2O42-的化学平衡
常数K=9.72×104.
(5)工业上用“双极室成对电解法”生产乙醛酸(HOOC-CHO),原理如图所示.该装置中阴、阳两极均为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸,该反应的化学方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,N电极的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
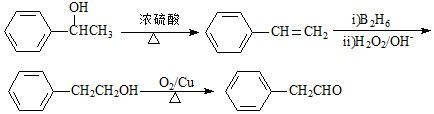
 . G的一种合成路线如下:
. G的一种合成路线如下:


 ;X生成Y的反应类型是消去反应.
;X生成Y的反应类型是消去反应.
 .
. .
.