题目内容
浓硫酸与下列物质反应时,既表现强酸性又表现强氧化性的是( )A.赤热的木炭
B.蔗糖遇浓硫酸变黑并膨胀
C.亚硫酸钠
D.铜片
解答:解:A.赤热的木炭和浓硫酸反应生成SO2、CO2和水,没有盐生成,S元素的化合价降低,只表现为强氧化性,故A错误;
B.蔗糖遇浓硫酸变黑,体现了浓硫酸的脱水性,木炭和浓硫酸反应生成SO2、CO2和水,蔗糖膨胀,S元素的化合价降低,表现为强氧化性,故B错误;
C.亚硫酸钠和浓硫酸发生反应生成硫酸钠、水和二氧化碳,有盐生成,但S元素的化合价不变,只表现为强酸性,故C错误;
D.铜片和H2SO4(浓)反应生成CuSO4、二氧化硫和水,有盐生成,S元素的化合价降低,既表现强酸性又表现强氧化性,故D正确;
故选D.
点评:本题考查浓硫酸的性质,题目难度不大,本题注意氧化性和酸性的判断角度,为解答该题的关键.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
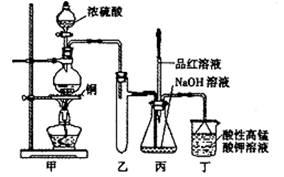
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: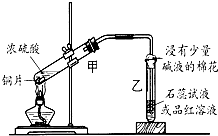 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.