题目内容
[2012·北京怀柔一模](11分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
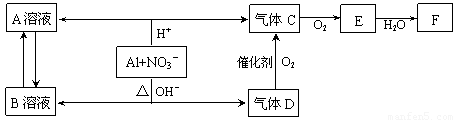
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 。
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O— + 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(11分)(1)Al(OH)3
(2)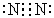
(3)8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3
(4)3NH3·H2O+Al3+ =Al(OH)3↓+3 NH4+
(5)4NH3+5O2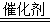 4NO+6 H2O
4NO+6 H2O
(6)3NO2+H2O=2HNO3+NO
(7)1:1
【解析】铝在酸性溶液中与NO3-发生氧化还原反应生成的A溶液中含Al3+,生成的气体C为NO, NO与O2反应生成的E为NO2,NO2与H2O生成的F为HNO3,气体D可催化氧化成NO且与HNO3反应生成盐,可推知D为NH3。
(1)A溶液中含Al3+,A和B两种溶液可相互转化且两溶液混合产生白色沉淀,可推出B溶液中含AlO2-。Al3+和AlO2-在溶液中发生双水解反应的离子方程式为:Al3++3AlO2-+ 6 H2O=4Al(OH)3↓。
(2)在催化剂存在下,NH3与NO或NO2发生氧化还原反应生成无毒的N2和H2O。
(3)结合前面的分析可知,金属铝在碱性溶液中与NO3-发生氧化还原反应生成AlO2-和NH3,据此可写出该反应的离子方程式:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3。
(4)解答本小题要注意NH3·H2O是弱碱,不能溶解Al(OH)3。
(5)NH3→NO的化学方程式为4NH3+5O2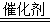 4NO+6 H2O。
4NO+6 H2O。
(6)用水可除去NO中的杂质NO2,反应的化学方程式为3NO2+H2O=2HNO3+NO。
(7)Al与NO3-在酸性条件下反应的方程式为Al+NO3-+4H+=Al3++NO↑+2H2O,据此可知Al与被还原的NO3-的物质的量之比为1:1

