题目内容
有机物A是由碳、氢两种元素或碳、氢、氧三种元素组成。现取0.1molA在6.72L氧气(标准状况)中充分燃烧,燃烧后的产物通过足量浓硫酸,浓硫酸增重3.6g。再在通过浓硫酸后的气体中点燃Mg条(足量),生成总质量为26.4g的黒、白两种物质,且黑色生成物与白色生成物的质量比为1:10,求A的分子式。
镁在CO2中燃烧的方程式为2Mg+CO2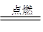 C+2MgO
C+2MgO
黑色生成物(C)与白色生成物(MgO)的物质量比为1∶10,物质的量之比是1︰3
所以根据方程式可知氧气过量,通过浓硫酸后的气体为CO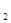 和O
和O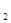 混合物。
混合物。
设镁和氧气反应生成的氧化镁是x,和CO2反应生成的氧化镁是,则
2Mg+O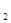 =2MgO 2Mg+CO
=2MgO 2Mg+CO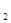 =2MgO+C
=2MgO+C
0.5x x y 0.5y
则有40(x+y)+12 × 0.5y=26.4 、 x+y="3" × 0.5y
得x="0.2" mol y="0.4" mol
过量的n(O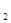 )=" 0.1" mol 生成的n(CO
)=" 0.1" mol 生成的n(CO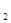 )=" 0.2" mol (4分)
)=" 0.2" mol (4分)
生成的n(H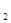 O)="3.6" ÷ 18=" 0.2" mol
O)="3.6" ÷ 18=" 0.2" mol
根据质量守恒定律可知0.1 molA的质量m(A)= 0.2×44+3.6-0.2×32="6" g
M(A)=6÷0.1=60
设A的分子式为C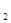 H
H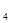 O
O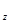 ,2×12+4×1+z×16,z=2,A的分子式为C
,2×12+4×1+z×16,z=2,A的分子式为C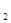 H
H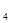 O
O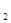 (4分)
(4分)
解析

练习册系列答案
相关题目


