题目内容
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E是一种非金属元素 | B.在ECln中E与Cl之间形成共价键 |
| C.E的一种常见氧化物为EO | D.E位于元素周期表的ⅥA族 |
C
试题分析:氯化物ECln的熔点为-78℃,沸点为59℃,常温下为液态,熔沸点较低是分子;由ECln+ nAgNO3===nAgCl↓+E(NO3)2,0.2molECln得到0.2n mol 即57.4g的AgCl沉淀,n=2,E不可能是金属,因为金属氯化物常温下都是固体,故E是非金属,只能是SCl2。故C不正确,S的氧化物为SO2或SO3。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
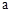 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为