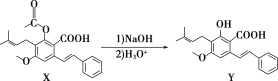
题目内容
【题目】常温下,用0.1 mol·L-1的盐酸和25.00 mL 0.1 mol·L-1氨水混合。
(1)当加入10.00 mL稀盐酸时,溶液中的溶质是________(填化学式),溶液的pH______(填“>”、“<”或“=”)7。
(2)当某一时刻溶液中c(NH4+)=c(Cl-),此时溶液的pH____(填“>”、“<”或“=”)7。所加的盐酸体积V ____(填“>”、“<”或“=”)25.00 mL。其原因是_______。
(3)某一时刻溶液中会不会存在:c(Cl-)>c(NH4+),且c(OH-)>c(H+)的关系?_____(填“会”或“不会”)。其原因是________。
(4)已知常温时 ,K(NH3·H2O)=1.8×10-5 当V(HCl)=12.50 mL时,下列离子浓度的大小关系是: c(Cl-) ___ c(NH4+) ,c(OH-) ___ c(H+)。(填“>”、“<”或“=”)。
【答案】NH4Cl,NH3·H2O > = < 若盐酸体积为25 mL时,NH3·H2O与HCl恰好完全反应,生成NH4Cl溶液呈酸性,故盐酸体积略少于25 mL (其它解释合理即可) 不会 否则溶液中离子所带电荷不守恒 (其它解释合理即可) < >
【解析】
常温下,用0.1 mol·L-1的盐酸和25.00 mL 0.1 mol·L-1氨水混合。
(1)当加入10.00 mL稀盐酸时,盐酸与氨水反应,消耗一水合氨0.001mol,剩余一水合氨0.0015mol,溶液中的溶质是氯化铵和一水合氨,此时以一水合氨的电离为主,溶液呈碱性;
(2)当某一时刻溶液中c(NH4+)=c(Cl-),按电荷守恒,此时溶液呈中性。可假设盐酸完全反应,通过分析氯化铵溶液的性质,反推所加盐酸的体积与25mL的关系;
(3)某一时刻溶液中不会存在:c(Cl-)>c(NH4+),且c(OH-)>c(H+)的关系,可从溶液呈电中性进行分析;
(4)已知常温时,K(NH3·H2O)=1.8×10-5 ,当V(HCl)=12.50 mL时,溶液中NH4Cl与NH3·H2O的浓度刚好相等,从电离常数进行计算,即K(NH3·H2O)=![]() =1.8×10-5 ,可得c(OH-)= 1.8×10-5mol/L ,c(H+)=
=1.8×10-5 ,可得c(OH-)= 1.8×10-5mol/L ,c(H+)=![]() =5.56×10-10mol/L,可得出c(OH-)与 c(H+)的关系,依据电荷守恒,可确定c(Cl-)与c(NH4+)的关系。
=5.56×10-10mol/L,可得出c(OH-)与 c(H+)的关系,依据电荷守恒,可确定c(Cl-)与c(NH4+)的关系。
常温下,用0.1 mol·L-1的盐酸和25.00 mL 0.1 mol·L-1氨水混合。
(1)当加入10.00 mL稀盐酸时,盐酸与氨水反应,消耗一水合氨0.001mol,剩余一水合氨0.0015mol,溶液中的溶质是氯化铵和一水合氨,此时以一水合氨的电离为主,溶液呈碱性,溶液的pH>7;答案为:NH4Cl,NH3·H2O;>;
(2)当某一时刻溶液中c(NH4+)=c(Cl-),按电荷守恒,此时溶液呈中性,pH=7;可假设盐酸完全反应,则生成氯化铵和水,因为氯化铵溶液中NH4+水解会使溶液呈酸性,所以所加盐酸的体积应小于25mL;答案为:=;<;若盐酸体积为25 mL时,NH3·H2O与HCl恰好完全反应,生成NH4Cl溶液,呈酸性,故盐酸体积略少于25 mL (其它解释合理即可);
(3)某一时刻溶液中不会存在:c(Cl-)>c(NH4+),且c(OH-)>c(H+)的关系,因为溶液呈电中性,两种阴离子浓度不可能同时大于阳离子浓度;答案为:不会;否则溶液中离子所带电荷不守恒 (其它解释合理即可);
(4)已知常温时 ,K(NH3·H2O)=1.8×10-5 ,当V(HCl)=12.50 mL时,溶液中NH4Cl与NH3·H2O的浓度刚好相等,从电离常数进行计算,即K(NH3·H2O)=![]() =1.8×10-5 ,可得c(OH-)= 1.8×10-5mol/L ,c(H+)=
=1.8×10-5 ,可得c(OH-)= 1.8×10-5mol/L ,c(H+)=![]() =5.56×10-10 mol/L,c(OH-)>c(H+),依据电荷守恒,可确定c(Cl-)<c(NH4+)。
=5.56×10-10 mol/L,c(OH-)>c(H+),依据电荷守恒,可确定c(Cl-)<c(NH4+)。
答案为:<;>。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案