题目内容
根据表中信息,判断下列叙述中正确的是
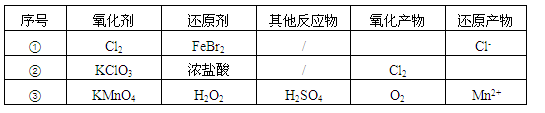

| A.表中①组的反应只可能有一种元素被氧化和一种元素被还原 |
| B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2 |
| C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 |
| D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O |
C
试题分析:A.表中①组的反应若Cl2过量,则发生反应:2Fe2++4Br-+3Cl2 = 2Fe3+ + 2Br2 + 6Cl-;若Cl2少量,则发生反应:2Fe2++Cl2 = 2Fe3++ 2Cl-;相对量的多少不同,被氧化的元素种类不同。错误。B.在氧化反应反应中,一般是氧化剂的氧化性大于氧化产物的氧化性。KClO3+6HCl(浓)
 KCl+ 3Cl2↑+3H2O,证明氧化性:KClO3>Cl2;2NaBr+Cl2 =2NaCl+ Br2;证明氧化性:Cl2>Br2; 2FeBr2 + 2Br2= 2FeBr3,证明氧化性:Br2>Fe3+。因此氧化性KClO3>Cl2>Br2>Fe3+。错误。C.在浓溶液中ClO3-、Br-、H+、Fe2+会发生氧化反应反应而不能大量共存。正确。D.表中③组反应的离子方程式为:2MnO4-+ 5H2O2 + 6H+=2Mn2+ + 5O2↑+ 8H2O
KCl+ 3Cl2↑+3H2O,证明氧化性:KClO3>Cl2;2NaBr+Cl2 =2NaCl+ Br2;证明氧化性:Cl2>Br2; 2FeBr2 + 2Br2= 2FeBr3,证明氧化性:Br2>Fe3+。因此氧化性KClO3>Cl2>Br2>Fe3+。错误。C.在浓溶液中ClO3-、Br-、H+、Fe2+会发生氧化反应反应而不能大量共存。正确。D.表中③组反应的离子方程式为:2MnO4-+ 5H2O2 + 6H+=2Mn2+ + 5O2↑+ 8H2O
练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
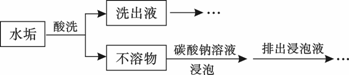
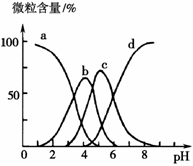
 、I-、NO
、I-、NO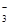
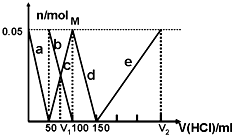
 H2↑+Cu2+
H2↑+Cu2+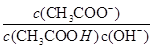 不变
不变