题目内容
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:

(1)下列有关石墨烯说法正确的是________________。
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含![]() 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________;第四周期元素中,最外层电子数与铜相同的元素还有________________________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________。
③下列分子属于非极性分子的是__________________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为________________。
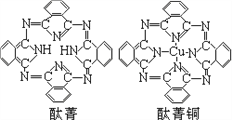
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):

它的化学式可表示为_____;在Au周围最近并距离相等的Cu有_____个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________g/cm3。(阿伏伽德罗常数用NA表示)
【答案】 BD 3d K、Cr 乙醇分子间可形成氢键而丁烷分子间不能形成氢键 a、c sp2 2 Cu3Au或AuCu3 12 38921/21030/(NAd34)
【解析】(1)A.金刚石中碳原子之间只存在σ键,石墨烯中碳原子之间存在σ键和π键,因此键长:石墨烯<金刚石,故A错误;B.石墨烯是平面形分子,分子中所有原子可以处于同一平面,故B正确;C.一个碳原子中含有![]() 个单键,即
个单键,即![]() 个σ键,所以12g石墨烯含σ键数为
个σ键,所以12g石墨烯含σ键数为![]() NA,故C错误;D.石墨层内是共价键,石墨层与层之间的作用力是范德华力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确;故选:BD;
NA,故C错误;D.石墨层内是共价键,石墨层与层之间的作用力是范德华力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确;故选:BD;
(2)①铜原子在基态时的电子排布式为1s22s22p63s23p63d104s1,在有电子填充的能级中,能量最高的能级符号为3d;第四周期元素中,最外层电子数与铜相同的元素还有3d04s1和3d54s1,即K和Cr,故答案为:3d;K、Cr;
②乙醇分子间存在氢键,使得其溶沸点升高,而丁烷不存在氢键,故答案为:乙醇分子间存在氢键,使得其溶沸点升高,而丁烷不存在氢键;
③a.甲烷为正四面体,结构对称,正负电荷的中心重合,属于非极性分子,故a正确;b.二氯甲烷为四面体分子,结构不对称,正负电荷的中心不重合,属于极性分子,故b错误;c.苯为平面正六边形,结构对称,正负电荷的中心重合,属于非极性分子,故c正确;d.乙醇结构不对称,正负电荷的中心不重合,属于极性分子,故d错误;故选:ac;
④酞菁分子中碳原子含有3个σ键和1个π键,所以采取sp2杂化;该分子中能提供孤对电子的氮原子才是配位原子,所以酞菁铜分子中心原子的配位数为2,故答案为:sp2;2;
⑤该晶胞中含Cu原子个数=6×![]() =3,含有Au=8×
=3,含有Au=8×![]() =1,所以其化学式为Cu3Au或AuCu3,根据图示,铜原子周围最近并距离相等的Au原子有4个,根据化学式,在Au周围最近并距离相等的Cu有12个;若2个Cu原子核的最小距离为d pm,则晶胞的棱长为
=1,所以其化学式为Cu3Au或AuCu3,根据图示,铜原子周围最近并距离相等的Au原子有4个,根据化学式,在Au周围最近并距离相等的Cu有12个;若2个Cu原子核的最小距离为d pm,则晶胞的棱长为![]() d pm=
d pm=![]() d×10-10cm,该晶体的密度=
d×10-10cm,该晶体的密度=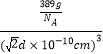 =
=![]() g/cm3,故答案为:Cu3Au或AuCu3;12;
g/cm3,故答案为:Cu3Au或AuCu3;12;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在三个容积均为1.0L的在恒容密闭容器中充入物质,发生反应:A(g)+B(g) ![]() 2D(g) 所得实验数据如下表:
2D(g) 所得实验数据如下表:
容器 | 温度/K | 物质的起始浓度/mol.L-1 | 平衡时物质的量浓度/mol.L-1 | ||
c(A) | c(B) | c(D) | c(D) | ||
Ⅰ | 400 | 0.20 | 0.20 | 0 | 0.080 |
Ⅱ | 600 | 0.40 | 0.10 | 0 | a |
Ⅲ | 600 | 0 | 0 | 0.40 | 0.20 |
请回答下列问题:
(1)该反应的正反应是吸热反应。判断的理由是_____________________________________________。
(2)在容器Ⅱ中,平衡时D物质的量浓度a=______________mol/L
(3)在保持容器Ⅲ的实验条件下,若起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L ,则达平衡时A的物质的量浓度为多少?(请写出解题过程) _______________

