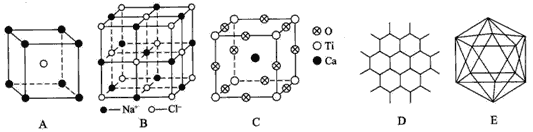
题目内容
【题目】利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
(1)反应的△H_________(填“>”“<”或“=’’,下同)

(2)以丙烯为燃料、熔融碳酸盐为电解质制作新型电池,放电时CO32-移向该电池的______(填“正极,或“负极”),当消耗2.8 L(标准状况)C3H6时,电路中转移电子的物质的量为__________。
(3)根据图中B点坐标计算,556℃时该反应酌平衡常数为______Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若图中A、B两点对应的平衡常数用K(A)、K (B)表示,则K(A) _____(填“>” “<”或“=”)K(B)。
【答案】 > 负极 2.25 mol 1.25×104 <
【解析】(1)随着温度升高,丙烷的物质的量分数降低,说明升高温度平衡向正反应方向进行,因此反应的△H>0;(2)原电池中阴离子向负极移动,所以放电时CO32-移向该电池的负极;碳元素化合价从-2价升高到+4价,1mol丙烯失去18mol电子。标准状况下2.8L丙烯是2.8L÷22.4L/mol=0.125mol,转移电子是0.125mol×18=2.25mol。(3)根据方程式可知
C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量(mol) n 0 0
转化量(mol) m m m
平衡量(mol) n-m m m
![]()
解得n=3m
所以556℃时该反应的平衡常数为![]() 。正方应吸热,升高温度平衡向正反应方向进行,平衡常数增大,因此K(A)<K(B)。
。正方应吸热,升高温度平衡向正反应方向进行,平衡常数增大,因此K(A)<K(B)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目