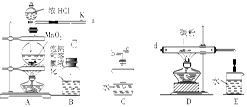��Ŀ����
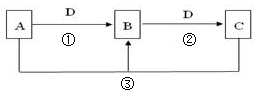
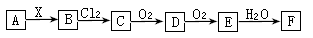
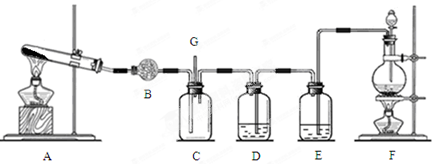
��11�֣������Ͱ����ڳ����»�ϼ��ɷ�����Ӧ��ij��ȤС��ͬѧΪ̽������������������백���ķ�Ӧ�����������װ�ã�
��ش�
��1��Aװ���е��Լ��� ��Bװ�õ����������� ��
��2��д��װ��F�з�����Ӧ�����ӷ���ʽ�� ������Ӧ���ܲ���560mL�������壨��״���£�����������Ҫ12mol/L��Ũ���� mL��
��3��װ��E��ʢ�ŵ��Լ��� ���������� ��
��4��װ��C���а��̲�������д����Ӧ�Ļ�ѧ����ʽ ��
��5������װ��C��G���ݳ���β���к�������Cl2��Ϊ��ֹ����Ⱦ�������ɽ�β��ͨ��ʢ�� ��ϴ��ƿ��

��ش�
��1��Aװ���е��Լ��� ��Bװ�õ����������� ��
��2��д��װ��F�з�����Ӧ�����ӷ���ʽ�� ������Ӧ���ܲ���560mL�������壨��״���£�����������Ҫ12mol/L��Ũ���� mL��
��3��װ��E��ʢ�ŵ��Լ��� ���������� ��
��4��װ��C���а��̲�������д����Ӧ�Ļ�ѧ����ʽ ��
��5������װ��C��G���ݳ���β���к�������Cl2��Ϊ��ֹ����Ⱦ�������ɽ�β��ͨ��ʢ�� ��ϴ��ƿ��
��1���Ȼ�李��������ƣ����Ȼ�李���ʯ�ң����Ȼ�李������ƣ��� �����
��2��MnO2 + 4 H+ + 2 Cl�� Mn2+ + Cl2 ��+ 2 H2O �� 8.3 ����8��8.33��25/3��
Mn2+ + Cl2 ��+ 2 H2O �� 8.3 ����8��8.33��25/3��
��3������ʳ��ˮ ��ȥ�����е�HCl����
��4��8NH3+3Cl2 ="==" N2+6NH4Cl ����2NH3+3Cl2 ="==" N2+6HCl NH3+HCl="=" NH4Cl��
��5������������Һ
��2��MnO2 + 4 H+ + 2 Cl��
 Mn2+ + Cl2 ��+ 2 H2O �� 8.3 ����8��8.33��25/3��
Mn2+ + Cl2 ��+ 2 H2O �� 8.3 ����8��8.33��25/3����3������ʳ��ˮ ��ȥ�����е�HCl����
��4��8NH3+3Cl2 ="==" N2+6NH4Cl ����2NH3+3Cl2 ="==" N2+6HCl NH3+HCl="=" NH4Cl��
��5������������Һ
�����������1��Aװ������ʵ������ȡ��������ʵ������һ���������������ȡ����������Aװ���е��Լ����Ȼ�李��������ơ�Bװ�õ��������Ƹ���ܡ���2����װ��F����ȡ������������Ӧ�����ӷ���ʽ��MnO2 + 4 H+ + 2 Cl��
 Mn2+ + Cl2��+ 2 H2O����n(Cl2)=0.560L��22.4L/mol=0.025mol������ֻ��Ũ����˷�����Ӧ������������Ҫ12mol/L��Ũ���ᣨ0.025mol��4����12mol/L=0.0083L=8.3ml����3������Ũ�����лӷ��ԣ������������ں�������HCl����װ��E��ʢ�ŵ��Լ��dz�ȥ�����е�HCl�ġ�Ӧ��Ϊ����ʳ��ˮ����4����װ��C�з�����Ӧ8NH3+3Cl2=N2+6NH4Cl��������ɫ����NH4Cl.��˻ῴ���а��̲�������5������װ��C��G���ݳ���β���к�������Cl2������Cl2����������ʷ�Ӧ������Ϊ��ֹ����Ⱦ�������ɽ�β��ͨ��ʢ������������Һ���Լ�ƿ�С�
Mn2+ + Cl2��+ 2 H2O����n(Cl2)=0.560L��22.4L/mol=0.025mol������ֻ��Ũ����˷�����Ӧ������������Ҫ12mol/L��Ũ���ᣨ0.025mol��4����12mol/L=0.0083L=8.3ml����3������Ũ�����лӷ��ԣ������������ں�������HCl����װ��E��ʢ�ŵ��Լ��dz�ȥ�����е�HCl�ġ�Ӧ��Ϊ����ʳ��ˮ����4����װ��C�з�����Ӧ8NH3+3Cl2=N2+6NH4Cl��������ɫ����NH4Cl.��˻ῴ���а��̲�������5������װ��C��G���ݳ���β���к�������Cl2������Cl2����������ʷ�Ӧ������Ϊ��ֹ����Ⱦ�������ɽ�β��ͨ��ʢ������������Һ���Լ�ƿ�С�
��ϰ��ϵ�д�
 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
�����Ŀ