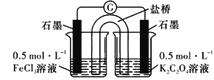
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )。
①3.9 g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1 g氧化钠和3.9 g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8 g 14CH4和水蒸气(H218O)的混合气体中含有的电子数目为NA
④常温下1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液所含![]() 的数目相同
的数目相同
⑤常温下,4.6 g NO2和N2O4的混合气体中所含原子总数为0.3NA
⑥将1 mol Cl2通入足量水中,溶液中HClO、Cl-、ClO-数目之和为2NA
⑦高温下,16.8 g Fe与足量水蒸气完全反应转移的电子数为0.8NA
A.①②④⑥B.②⑤⑦
C.②③⑥⑦D.③⑤⑥⑦
【答案】B
【解析】
①苯分子中没有碳碳双键,①不正确;
②氧化钠和过氧化钠的组成中,其阴、阳离子的个数比相同,都是1:2,3.1g氧化钠和3.9g过氧化钠的物质的量均为0.05mol,故混合物中含有的阴离子总数为0.05 NA +0.05 NA=0.1NA,②正确;
③14CH4和水蒸气(H218O)的分子内均有10个电子,14CH4和H218O的摩尔质量不同,所以1.8g14CH4和水蒸气(H218O)的混合气体的物质的量不相同,所含电子数目也就不相等,③不正确;
④在相同温度下,NH4+的水解程度随浓度增大而减小,故常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目不相同,④不正确;
⑤NO2和N2O4的最简式相同,均为NO2,4.6gNO2的物质的量为0.1mol,原子的物质的量=0.1mol×3=0.3mol,所以4.6gNO2和N2O4的混合气体中所含原子总数为0.3NA,⑤正确;
⑥Cl2通入足量水中,所得溶液中含有Cl2、HClO、Cl-、C1O-等粒子。由物料守恒可知,将1molCl2通入足量水中,溶液中HClO、Cl-、C1O-粒子数之和小于2NA,⑥不正确;
⑦高温下,Fe与水蒸气反应生成Fe3O4,16.8gFe的物质的量为0.3mol Fe,故16.8gFe与足量水蒸气完全反应转移电子数为0.3NA×![]() =0.8NA,⑦正确;
=0.8NA,⑦正确;
综上所述,②⑤⑦正确。
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】NO是大气污染物之一,在一定条件下,采用活性炭可发生下列反应:2NO(g)+C(s) ![]() N2(g)+CO2(g)。现在温度一定,容积为1 L的密闭容器中发生该反应,各物质的物质的量如下表所示:
N2(g)+CO2(g)。现在温度一定,容积为1 L的密闭容器中发生该反应,各物质的物质的量如下表所示:
物质 | NO | 活性炭 | N2 | CO2 |
起始物质的量/mol | 0.100 | 1.030 | 0 | 0 |
2 min时的物质的量/mol | a | b | 0.030 | 0.030 |
下列判断正确的是
A.表格中的a∶b=2∶1
B.2 min内,v(NO)=0.015 mol·L-1·min-1
C.若该温度下,反应的平衡常数为![]() ,则2 min时反应已经达到平衡
,则2 min时反应已经达到平衡
D.增加活性炭可以提高NO的转化率