题目内容
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
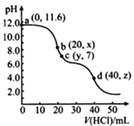
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
【答案】D
【解析】碳酸钠溶液水解显碱性,水解平衡常数Kh=c(HCO3-)×c(OH-)/c(CO32-)=Kw/Ka2,由碳酸钠溶液水解规律可知,水解达平衡后c(HCO3-)≈c(OH-)=10-2.4 mol·L-1,c(CO32-)≈0.1000 mol·L-1,所以Kw/Ka2=10-2.4×10-2.4/0.1, Ka2=10-10.2, A错误;c点处溶液为中性,根据电荷守恒规律:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(Cl-),由于c(OH-)=c(H+),所以:c(Na+)>2c(CO32-)+c(HCO3-),B错误;a点溶液为碳酸钠,能够发生水解,促进水的电离,水的c(OH-)=10-2.4 mol·L-1,c点为中性溶液,对水的平衡无影响,水的c(OH-)=10-7 mol·L-1, C错误;当盐酸滴加到40.00 mL,pH=5.6,d点溶液显酸性,溶液为氯化钠和碳酸的混合液,因此,c(Na+)=c(Cl-)>c(H2CO3)>c(OH-),D正确;正确选项D。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A.A
B.B
C.C
D.D
【题目】乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) ![]() C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3-环己二烯(g)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
(4)1,3-环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。