题目内容
现有①NaCl②金刚石 ③NH4Cl ④Na2SO4⑤干冰 ⑥NaOH六种物质,按下列要求回答:(注意(1)(3)两小题用序号填入)
(1)属于离子化合物的是
(2)①的电子式是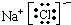
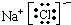 ,⑤的电子式是
,⑤的电子式是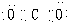
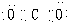 .
.
(3)熔化时不需要破坏化学键的是
(1)属于离子化合物的是
①③④⑥
①③④⑥
,只有离子键的物质是①
①
,晶体以分子间作用力结合的是⑤
⑤
.(2)①的电子式是
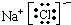
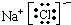
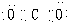
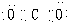
(3)熔化时不需要破坏化学键的是
⑤
⑤
,熔化时需要破坏共价键的是②
②
,硬度最高的是②
②
,熔点最低的是⑤
⑤
.分析:(1)活泼金属和活泼非金属一般形成离子化合物,离子化合物中一定含有离子键,可能含有共价键,共价化合物中一定没有离子键.在分子晶体中存在分子间作用力.
(2)先判断化合物类型,离子化合物电子式的书写:简单阳离子只写元素符号和电荷、电性,阴离子写出其最外层电子然后用方括号括起来写出电荷、电性;共价化合物电子式的书写:写出共用电子对及各原子的最外层电子数.
(3)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏化学键的是原子晶体、离子晶体、金属晶体;硬度最高的是原子晶体,熔点最低的是分子晶体.
(2)先判断化合物类型,离子化合物电子式的书写:简单阳离子只写元素符号和电荷、电性,阴离子写出其最外层电子然后用方括号括起来写出电荷、电性;共价化合物电子式的书写:写出共用电子对及各原子的最外层电子数.
(3)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏化学键的是原子晶体、离子晶体、金属晶体;硬度最高的是原子晶体,熔点最低的是分子晶体.
解答:解:(1)①NaCl是离子晶体,属于离子化合物,只含有离子键;
②金刚石是原子晶体,属于单质,含有非极性共价键;
③NH4Cl是离子晶体,属于离子化合物,含有离子键和极性共价键;
④Na2SO4是离子晶体,属于离子化合物,含有离子键和极性共价键;
⑤干冰 是分子晶体,属于共价化合物,含有极性共价键,分子间以分子间作用力结合.
⑥NaOH离子晶体,属于离子化合物,含有离子键和极性共价键;
故答案为:①③④⑥;①;⑤.
(2)NaCl是离子化合物,其电子式为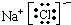
干冰 是共价化合物,其电子式为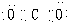
故答案为: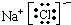 ;
; 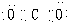 .
.
(3)熔化时不需要破坏化学键的是分子晶体,干冰是分子晶体,故选⑤;
熔化时需要破坏共价键的是原子晶体,金刚石是原子晶体,故选②;
硬度最大的是原子晶体,金刚石是原子晶体,故选②;
熔点最低的是分子晶体,干冰是分子晶体,故选⑤;
故答案为:⑤;②;②;⑤.
②金刚石是原子晶体,属于单质,含有非极性共价键;
③NH4Cl是离子晶体,属于离子化合物,含有离子键和极性共价键;
④Na2SO4是离子晶体,属于离子化合物,含有离子键和极性共价键;
⑤干冰 是分子晶体,属于共价化合物,含有极性共价键,分子间以分子间作用力结合.
⑥NaOH离子晶体,属于离子化合物,含有离子键和极性共价键;
故答案为:①③④⑥;①;⑤.
(2)NaCl是离子化合物,其电子式为
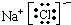
干冰 是共价化合物,其电子式为
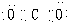
故答案为:
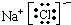 ;
; 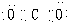 .
.(3)熔化时不需要破坏化学键的是分子晶体,干冰是分子晶体,故选⑤;
熔化时需要破坏共价键的是原子晶体,金刚石是原子晶体,故选②;
硬度最大的是原子晶体,金刚石是原子晶体,故选②;
熔点最低的是分子晶体,干冰是分子晶体,故选⑤;
故答案为:⑤;②;②;⑤.
点评:本题考查了晶体类型与其性质的关系、化学键、电子式的书写等知识点,难度不大,根据基础知识解答即可.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目