题目内容
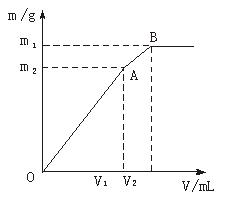
向含0.02 mol Al3+的明矾溶液中逐滴加入0.2 mol·L-1的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入的Ba(OH)2溶液的体积V的关系如右图所示。
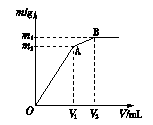
(1)写出两个阶段OA、AB反应的离子方程式。
OA段: ;
AB段: 。
(2)计算出A点、B点所对应的m、V以及沉淀的化学式,填在下面横线上。
V1= ,m1= ,沉淀的化学式 ;
V2= ,m2= ,沉淀的化学式 。
(1)3Ba2++6OH-+2Al3++3![]()
![]() 3BaSO4↓+2Al(OH)3↓
3BaSO4↓+2Al(OH)3↓
2Al(OH)3+![]() +Ba2++2OH-
+Ba2++2OH-![]() BaSO4↓+2
BaSO4↓+2![]() +4H2O
+4H2O
(2)150 mL 8.55 g Al(OH)3、BaSO4
200 mL 9.32 g BaSO4
解析:
含0.02 mol Al3+的明矾溶液,含n(![]() )=0.02mol×2=0.04 mol。向其中加入Ba(OH)2,刚开始生成BaSO4和Al(OH)3,至Al3+完全沉淀,消耗V〔Ba(OH)2〕=
)=0.02mol×2=0.04 mol。向其中加入Ba(OH)2,刚开始生成BaSO4和Al(OH)3,至Al3+完全沉淀,消耗V〔Ba(OH)2〕=![]() =0.15 L=150 mL,此时过量的n(
=0.15 L=150 mL,此时过量的n(![]() )=0.04 mol-0.2 mol·L-1×0.15 L=0.01 mol;继续加Ba(OH)2至200 mL,此过程Al(OH)3逐渐溶解至完全,但
)=0.04 mol-0.2 mol·L-1×0.15 L=0.01 mol;继续加Ba(OH)2至200 mL,此过程Al(OH)3逐渐溶解至完全,但![]() 逐渐沉淀至完全。由于此过程中溶解m〔Al(OH)3〕=0.02 mol×78 g·mol-1=1.56 g,生成m(BaSO4)=0.01 mol×233 g·mol-1=2.33 g,故沉淀总质量仍然增加。
逐渐沉淀至完全。由于此过程中溶解m〔Al(OH)3〕=0.02 mol×78 g·mol-1=1.56 g,生成m(BaSO4)=0.01 mol×233 g·mol-1=2.33 g,故沉淀总质量仍然增加。