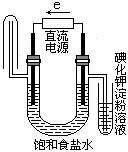
题目内容
Cl2和一定浓度的KOH反应,生成KCl、KClO3、KClO和H2O.当ClO-3与ClO-的物质的量之比为2:5时,被氧化的氯与被还原的氯的物质的量之比为( )
| A.1:7 | B.1:9 | C.7:15 | D.2:9 |
Cl2生成ClO3-与ClO-是被氧化的过程,化合价分别由0价升高为+5价和+1价,
ClO3-与ClO-的物质的量浓度之比为2:5,
则可设ClO3-为2mol,ClO-为5mol,被氧化的Cl共为7mol,
失去电子的总物质的量为2mol×(5-0)+5mol×(1-0)=15mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为15mol,
则被还原的Cl的物质的量为15mol,
所以被氧化的氯元素和被还原的氯元素的物质的量之比为7mol:15mol=7:15,
故选C.
ClO3-与ClO-的物质的量浓度之比为2:5,
则可设ClO3-为2mol,ClO-为5mol,被氧化的Cl共为7mol,
失去电子的总物质的量为2mol×(5-0)+5mol×(1-0)=15mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为15mol,
则被还原的Cl的物质的量为15mol,
所以被氧化的氯元素和被还原的氯元素的物质的量之比为7mol:15mol=7:15,
故选C.

练习册系列答案
相关题目

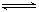 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2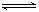 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3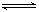 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式 HSO3-+OH-
HSO3-+OH- 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是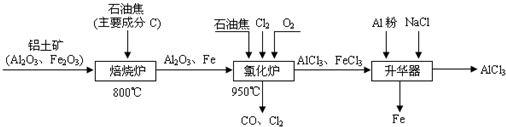

 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2  的取值范围是_________________。
的取值范围是_________________。 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):  A.反应:I2(aq)+I¯(aq)
A.反应:I2(aq)+I¯(aq) 






 B、
B、
 D、
D、