题目内容
【题目】下列说法正确的是( )
A.H216O和H218O属于同位素
B.相同体积的CO2、NO2具有相同的分子数
C.NaCl溶液能导电,所以NaCl溶液是电解质
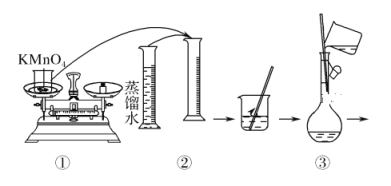
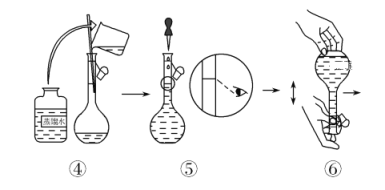
D.配制溶液时,容量瓶中原来有少量蒸馏水不会影响实验结果
【答案】D
【解析】
A.H216O和H218O不是核素,都表示水,二者不是同位素,故A错误;
B.气体状况未知,依据阿伏加德罗定律,相同体积的CO2、NO2不一定具有相同分子数,故B错误;
C.氯化钠溶液为混合物,不是电解质,故C错误;
D.定容操作需要继续加入蒸馏水,所以配制溶液时,容量瓶中原来有少量蒸馏水不会影响实验结果,故D正确;
故选:D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目