题目内容
在一定温度下,反应H2(g)+X2(g) 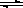 HX(g)的平衡常数为10。则反应2HX(g)
HX(g)的平衡常数为10。则反应2HX(g)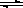 H2(g)+X2(g)的平衡常数为( )
H2(g)+X2(g)的平衡常数为( )
A 0.01 B 1 C 10 D 100
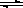 HX(g)的平衡常数为10。则反应2HX(g)
HX(g)的平衡常数为10。则反应2HX(g)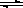 H2(g)+X2(g)的平衡常数为( )
H2(g)+X2(g)的平衡常数为( )A 0.01 B 1 C 10 D 100
A
平衡常数是指:可逆反应达到平衡后,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数;反应H2(g)+X2(g) 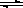 HX(g)的平衡常数为10,则H2(g)+X2(g)
HX(g)的平衡常数为10,则H2(g)+X2(g)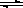 2HX(g)的平衡常数为100;所以反应2HX(g)
2HX(g)的平衡常数为100;所以反应2HX(g)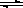 H2(g)+X2(g)的平衡常数为0.01
H2(g)+X2(g)的平衡常数为0.01
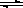 HX(g)的平衡常数为10,则H2(g)+X2(g)
HX(g)的平衡常数为10,则H2(g)+X2(g)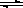 2HX(g)的平衡常数为100;所以反应2HX(g)
2HX(g)的平衡常数为100;所以反应2HX(g)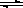 H2(g)+X2(g)的平衡常数为0.01
H2(g)+X2(g)的平衡常数为0.01
练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
 2HBr(g),达到平衡的标志是
2HBr(g),达到平衡的标志是 Si(s)+4HCl(g)
Si(s)+4HCl(g) 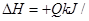 mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是
2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是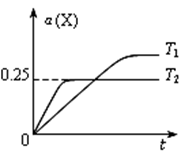
 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同) 
 2C(g),△H<0。
2C(g),△H<0。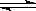 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。