题目内容
把ag铁铝粉末溶于足量的盐酸中,加入过量的NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为ag,则原合金中铁的质量分数为( )
A.70% B.52.4% C.47.6% D.30%
【答案】
A
【解析】
试题分析:金属铁和铝溶于盐酸中,分别生成氯化亚铁和氯化铝。加入过量的NaOH溶液后又分别生成氢氧化亚铁和偏氯酸钠,而氢氧化亚铁最终生成氢氧化铁红褐色沉淀。氢氧化铁进一步灼烧则生成氧化铁,即最终得到的红棕色粉末是氧化铁。由于原混合物的质量和氧化铁的质量相等,又因为铁原子是守恒的,这说明原合金中铁的质量分数和氧化铁中铁的质量分数是相等的,即原合金中铁的质量分数为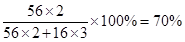 ,答案选A。
,答案选A。
考点:考查金属和酸反应的有关计算
点评:该题属于常见的高考题型,为中等难度的试题。本题也是一道典型的利用原子守恒进行的化学计算,高考中的化学计算大部分都是采用巧解进行的,所以需要学生在平时的训练注意积累和总结。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目