题目内容
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在; pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (写离子方程式)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
①酸性气体是 (填化学式)
②X的结构简式为 。
(1)2821.6;
(2)0.3mol;
(3)①4~5.5 c(HPO42-)>c(H2PO4)②3Ca2++2H PO42-=Ca3(PO4)2+2H+
(4)①HCl ②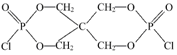
解析试题分析:(1)①+②×6整理可得2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3=ΔH1+6×ΔH2=+3359.26+6×(-89.61)=2821.6kJ/mol. (2)由方程式11P4+60CuSO4 +96H2O
6CaSiO3(s)+P4(s)+10CO(g)ΔH3=ΔH1+6×ΔH2=+3359.26+6×(-89.61)=2821.6kJ/mol. (2)由方程式11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 可知:P4在反应中既作氧化剂又作还原剂。CuSO4作氧化剂。每1mol的CuSO4得到电子1mol。而每1mol的P4在反应中作还原剂能失去电子20mol的电子。即1mol的P4在反应中作还原剂需要消耗20mol的CuSO4,则6 mol CuSO4能氧化白磷的物质的量是6÷20=0.3mol。(3)由含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系图可知:①为获得尽可能纯的NaH2PO4,pH应控制pH在4~5.5。在pH=8时溶液中主要含磷物种有Na2HPO4和NaH2PO4二者浓度大小关系为c(HPO42-)>c(H2PO4--)。②Na2HPO4溶液显碱性,是因为在溶液在存在电离平衡:HPO42-
20Cu3P +24H3PO4+60H2SO4 可知:P4在反应中既作氧化剂又作还原剂。CuSO4作氧化剂。每1mol的CuSO4得到电子1mol。而每1mol的P4在反应中作还原剂能失去电子20mol的电子。即1mol的P4在反应中作还原剂需要消耗20mol的CuSO4,则6 mol CuSO4能氧化白磷的物质的量是6÷20=0.3mol。(3)由含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系图可知:①为获得尽可能纯的NaH2PO4,pH应控制pH在4~5.5。在pH=8时溶液中主要含磷物种有Na2HPO4和NaH2PO4二者浓度大小关系为c(HPO42-)>c(H2PO4--)。②Na2HPO4溶液显碱性,是因为在溶液在存在电离平衡:HPO42- H++ PO43-和水解平衡:H2O+HPO42-
H++ PO43-和水解平衡:H2O+HPO42- H2PO4--+OH-。由于水解大于电离,所以溶液显碱性。若向溶液中加入足量的CaCl2溶液,则会发生反应:2PO43-+3Ca2+=Ca3(PO4)2↓。促使平衡向电离的方向移动,最终使溶液显酸性。总方程式为3Ca2++2H PO42-=Ca3(PO4)2+2H+。(4)由它们反应时的物质的量的关系、质量守恒定律及得到的物质的核磁共振氢谱图可以确定①酸性气体是HCl,②X的结构简式为
H2PO4--+OH-。由于水解大于电离,所以溶液显碱性。若向溶液中加入足量的CaCl2溶液,则会发生反应:2PO43-+3Ca2+=Ca3(PO4)2↓。促使平衡向电离的方向移动,最终使溶液显酸性。总方程式为3Ca2++2H PO42-=Ca3(PO4)2+2H+。(4)由它们反应时的物质的量的关系、质量守恒定律及得到的物质的核磁共振氢谱图可以确定①酸性气体是HCl,②X的结构简式为 。
。
考点:考查盖斯定律的应用、氧化还原反应中氧化剂与还原剂的电子转移关系、微粒的浓度与溶液的酸碱性的关系和核磁共振氢谱在确定物质结构中的应用的知识。

标准状况下2.24LH2和Cl2组成的混合气体,经光照后缓缓通入100ml 1mol/LNaOH溶液中充分反应,测得最终溶液中NaClO的浓度为0.1mol/L(假设溶液体积不变,且不考虑水解),则原混合气体中Cl2的体积分数为( )
| A.55% | B.60% | C.65% | D.70% |
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
实验操作及现象:
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为 ;操作Ⅰ的目的是 ;D装置的作用是 。
(2)C装置中白色沉淀的化学式是 ,操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是 。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是 。
(4)E装置内气体颜色逐渐加深的原因是 。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明) 。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| | 操作 | 实验现象 |
| a | 取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色, 水层显浅黄色。 |
| b | 取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色,水层几近无色。 |
① 实验b的目的是 。
② 根据实验a中,水层中含有的粒子有 。
③ 实验a中水溶液颜色变浅的原因是 。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(3) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)还原炉中发生的化学反应为: 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
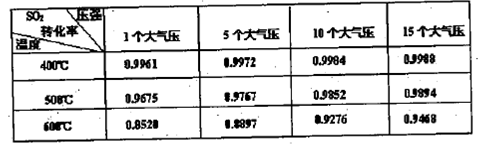
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:

碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。

 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。


 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式