题目内容
(2010?武汉模拟)下列关于电解质溶液的叙述正确的是( )
分析:A、根据碳酸根离子和碳酸氢根离子的水解程度来分析水解生成的氢氧根离子的浓度;
B、依据溶液中的电荷守恒分析判断;
C、硝酸是强酸,醋酸是弱电解质,pH与体积均相同的硝酸和醋酸溶液,醋酸的浓度大,则消耗的碱多.
D、依据一定温度下的水溶液中存在离子积常数分析,氢离子浓度减少,氢氧根离子浓度增大;
B、依据溶液中的电荷守恒分析判断;
C、硝酸是强酸,醋酸是弱电解质,pH与体积均相同的硝酸和醋酸溶液,醋酸的浓度大,则消耗的碱多.
D、依据一定温度下的水溶液中存在离子积常数分析,氢离子浓度减少,氢氧根离子浓度增大;
解答:A、常温下,同浓度的Na2CO3与NaHCO3溶液相比,碳酸根离子水解程度大于碳酸氢根离子水解程度,碳酸钠溶液的碱性强,PH大,故A正确;
B、常温下,pH=7的NH4Cl与氨水的混合溶液呈中性,存在的电荷守恒为[H+]+[NH4+]=[Cl-]+[OH-],由于中性溶液[H+]=[OH-],所以[NH4+]=[Cl-],故B错误;
C、pH与体积均相同的硝酸和醋酸溶液中醋酸的物质的量浓度大,则醋酸的物质的量大,故与氢氧化钠反应时消耗的氢氧化钠多,故D错误;
D、将pH=4的盐酸稀释后,溶液中的氢离子浓度减少,依据离子积常数可知溶液中氢氧根离子浓度增大,故D错误;
故选A.
B、常温下,pH=7的NH4Cl与氨水的混合溶液呈中性,存在的电荷守恒为[H+]+[NH4+]=[Cl-]+[OH-],由于中性溶液[H+]=[OH-],所以[NH4+]=[Cl-],故B错误;
C、pH与体积均相同的硝酸和醋酸溶液中醋酸的物质的量浓度大,则醋酸的物质的量大,故与氢氧化钠反应时消耗的氢氧化钠多,故D错误;
D、将pH=4的盐酸稀释后,溶液中的氢离子浓度减少,依据离子积常数可知溶液中氢氧根离子浓度增大,故D错误;
故选A.
点评:本题考查了盐类水解的程度比较,电解质溶液中的电荷守恒应用,强酸弱酸的中和反应,溶液中离子积常数的应用.

练习册系列答案
相关题目
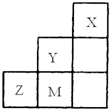 (2010?武汉模拟)如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
(2010?武汉模拟)如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )