题目内容
用98%的浓硫酸(密度为1.84g/cm3配制100mL 1 mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是( )
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
D
试题分析:配制一定物质的量浓度的溶液的实验步骤:计算、称量或量取、溶解、移液、洗涤、定容、摇匀,由实验步骤确定所用仪器。首先用公式
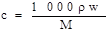 计算98%的浓H2SO4的物质的量浓度为18.4mol/L,再利用稀释定律公式c1V1=c2V2计算配制1mol/L的稀硫酸100mL,需要浓硫酸的体积为5.4 mL应选择10 mL量筒,量取用到10 mL量筒、胶头滴管,溶解用到烧杯、玻璃棒,移液要向100mL容量瓶中转移,定容最后又用到胶头滴管,所以正确顺序为②⑥③⑦⑤⑥,选D。
计算98%的浓H2SO4的物质的量浓度为18.4mol/L,再利用稀释定律公式c1V1=c2V2计算配制1mol/L的稀硫酸100mL,需要浓硫酸的体积为5.4 mL应选择10 mL量筒,量取用到10 mL量筒、胶头滴管,溶解用到烧杯、玻璃棒,移液要向100mL容量瓶中转移,定容最后又用到胶头滴管,所以正确顺序为②⑥③⑦⑤⑥,选D。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA
2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA