题目内容
能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
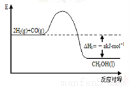
CO的燃烧热△H2=-bkJ·mol-1,CH3OH的燃烧热
△H3=-ckJ·mol-1。请根据以上信息,回答下列有关问题:
(1)甲醇是一种(填“可”或“不可”)再生能源,甲醇的官能团的电子式是 。
(2)CH3OH燃烧的热化学反应方程式为。
(3)H2的燃烧热△H=。
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为e kJ/mol;C=O为fkJ/mol。则由以上数据有b=
kJ/mol;C=O为fkJ/mol。则由以上数据有b=
(用d、e、f的代数式表示)。
(5)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为。
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的正极反应式。
练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目



 Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+ 2Fe+Al2O3
2Fe+Al2O3