题目内容
【题目】碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
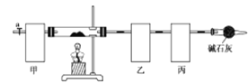
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)

甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。

①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
【答案】(1)D A D吸收空气中的二氧化碳和水蒸气,减少实验误差。
(2)检验装置气密性不再有气泡产生时将生成的CO2和水全部赶入乙和丙中吸收(3)Co3(OH)4(CO3)2 (4)①品红色溶液不变色,澄清石灰水变浑浊②首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释100倍再测pH,若△pH<2,则说明亚硫酸未完全电离,是弱酸
【解析】
试题分析:(1)利用空气先通过装置D干燥管中的碱石灰除去空气中的二氧化碳和水蒸气,剩余气体把生成的水蒸气和二氧化碳赶入装置乙和丙完全吸收,玻璃管中加热分解碱式碳酸钴[Cox(OH)y(CO3)z],生成气体通过装置A中的浓硫酸吸收水蒸气测定生成水的质量,通过装置D中碱石灰吸收生成的二氧化碳气体测定生成二氧化碳的质量,最后的碱石灰干燥管防止空气中的二氧化碳和水蒸气进入装置丙影响测定结果,甲装置的作用是吸收空气中的H2O和CO2,减少实验误差;(2)步骤②中省略的实验操作为检验装置气密性;③加热玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;(3)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,故生成水的质量为80.36g-80.00g=0.36g,物质的量为0.36g÷18g/mol=0.02mol;反应前丙装置的质量为62.00g,反应后质量为62.88g,生成二氧化碳的质量为62.88g-62.00g=0.88g,物质的量为0.88g÷44g/mol=0.02mol,故Co的质量为3.65g-0.02mol×2×17g/mol-0.02mol×60g/mol=1.77g,故Co原子物质的量为:1.77g÷59g/mol=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2;(4)①根据装置图可知,二氧化硫通入碳酸氢钠溶液中能产生二氧化碳,通过装置A中高锰酸钾溶液,二氧化硫被吸收,品红可以检验二氧化硫被吸收干净,再通过装置B中澄清石灰水,石灰水变混浊,说明在碳酸氢钠溶液中有二氧化碳产生,所以该实验的实验目的为比较亚硫酸与碳酸酸性的强弱,因此该实验能达到实验目的的实验现象品红色溶液不变色,澄清石灰水变浑浊;②证明亚硫酸是弱电解质的实验方案为:用pH计可测定溶液中氢离子的浓度,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸或用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案