题目内容
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子F层结构, X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Zl
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1, |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___________________ ___ _______。
___ _______。
向混合溶液甲中缓慢滴加溶液乙,反应生成沉淀的质量如图所示,其中可能符合图象的一组是
甲 | 乙 |
| |
A. | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
B. | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
C. | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
D. | NaAlO2、NH3·H2O、NaOH | H2SO4 |


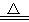 Cu+H2O,该反应中( )
Cu+H2O,该反应中( )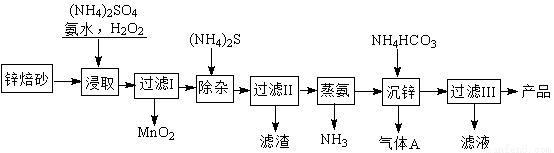
 取少量装入试管B中,加热A
取少量装入试管B中,加热A
 H2O(未配平)。则有关叙述不正确的是
H2O(未配平)。则有关叙述不正确的是 Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是