题目内容
【题目】可逆反应aA(g)+ bB(g)![]() cC(g)+ dD(g)达到平衡时,各物质的浓度满足以下关系:
cC(g)+ dD(g)达到平衡时,各物质的浓度满足以下关系:![]() =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+ H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH <0,在850°C时,K =1。
CO2(g)+ H2(g) ΔH <0,在850°C时,K =1。
(1)若升高温度到950°C,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850°C时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850°C时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
【答案】(1)小于
(2)①逆反应 ②0<x<3.0
(3)小于
【解析】(1)从题给信息知,正反应是放热反应,升高温度,平衡向逆反应方向移动,CO2和H2的浓度将减小,而CO和H2O(g)的浓度将增大,故K值减小。
(2)温度不变,K值不变,设容器体积为V,当x=5.0时,此时![]() =
=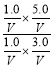 =
=![]() >1,故平衡向逆反应方向移动,若要使上述反应开始时向正反应方向进行,则满足
>1,故平衡向逆反应方向移动,若要使上述反应开始时向正反应方向进行,则满足![]() <K,即
<K,即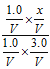 <1,得x<3.0。(3)x=6.0时,相当于在x= 5.0的基础上加入了 1.0 mol H2,根据勒夏特列原理可知x = 6.0时H2的体积分数大于x= 5.0时。
<1,得x<3.0。(3)x=6.0时,相当于在x= 5.0的基础上加入了 1.0 mol H2,根据勒夏特列原理可知x = 6.0时H2的体积分数大于x= 5.0时。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目