题目内容
(12分)有甲、乙两份等体积的浓度均为0.1 mol/L的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡将向______(选填“促进”或“抑制”)电离的方向移动,溶液的pH将为______(选填序号).
A.9~11之间 B.11
C.12~13之间 D.13
(2)乙用0.1 mol/L的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH______(选填“甲大”“乙大”或“相等”),其原因是__________________________
________________________________________________________________________.
【答案】
(1)促进 A (2)甲大 由于c(NH)增大,抑制了氨水的电离,使得c(OH-)减小得更多
【解析】试题分析:(1)氨水是弱电解质,越稀越电离,加水稀释会促进电离,强碱每稀释10倍PH值减少1,从11减少到9,但是氨水是弱碱,变化程度要慢,所以PH大于9,所以在9-11之间故选A。(2)由于c(NH)增大,抑制了氨水的电离,使得c(OH-)减小得更多,所以甲的PH大。
考点:弱碱的稀释
点评:弱碱在稀释中,越稀越电离,向氨水中加氯化铵,会抑制水解。本题常考题,难度适中。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
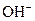 、H+、
、H+、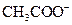 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系: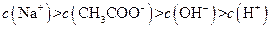
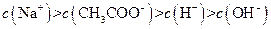
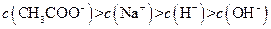
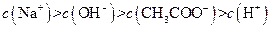
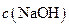
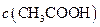 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前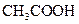 溶液中的
溶液中的
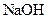 溶液中的
溶液中的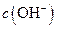 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
 ____;
____;
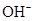 、H+、
、H+、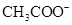 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系: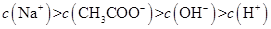
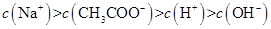
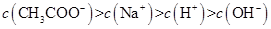
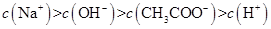
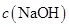
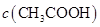 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前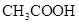 溶液中的
溶液中的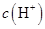
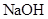 溶液中的
溶液中的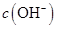 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。