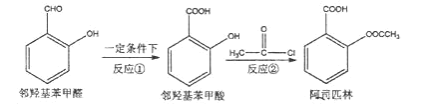
题目内容
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2
③SiHCl3与过量H2在1 100 ℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_____。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):

①装置B中的试剂是_____,装置C中的烧瓶需要加热,其目的是______。
②反应一段时间后,装置D中观察到的现象是____,装置D中发生反应的化学方程式为____。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是____(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
【答案】SiO2+2C![]() Si+2CO↑ 蒸馏 浓硫酸 使滴入烧瓶中的SiHCl3气化 有固体物质生成 SiHCl3+H2
Si+2CO↑ 蒸馏 浓硫酸 使滴入烧瓶中的SiHCl3气化 有固体物质生成 SiHCl3+H2![]() Si+3HCl 排尽装置中的空气 bd
Si+3HCl 排尽装置中的空气 bd
【解析】
本实验是利用SiHCl3和氢气反应制取纯硅,首先在装置A利用稀硫酸和锌粒反应制取氢气,SiHCl3能与H2O强烈反应、在空气中易自燃,所以需要装置B中盛放浓硫酸将生成的氢气进行干燥、并用氢气排尽装置中的空气;水浴加热装置C,使SiHCl3挥发,和氢气一同进入石英管中在高温条件下反应制取纯硅。
(1)高温下,SiO2和C反应生成Si和CO,反应的化学方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)沸点不同的液体混合物可以采用蒸馏的方法分离,这几种物质沸点不同,所以采用蒸馏的方法分离;
(3)①为防止SiHCl3与H2O强烈反应,需要干燥剂干燥氢气,浓硫酸具有吸水性且不和氢气反应,所以装置B中可以盛放浓硫酸;加热装置C中烧瓶,升高温度能使SiHCl3气化,从而使SiHCl3和氢气在D中反应;
②D中发生反应SiHCl3+H2![]() Si+3HCl,Si为固态,所以看到的现象是有固体物质生成;
Si+3HCl,Si为固态,所以看到的现象是有固体物质生成;
③SiHCl3能与H2O强烈反应、在空气中易自燃,且Si是亲氧元素,为防止SiHCl3自燃和Si被氧化,需要排尽装置中的空气;
④若含铁单质,加入稀盐酸后溶液中应含Fe2+;检验Fe2+先加入KSCN溶液无明显现象,再加入氯水溶液变红色即可,故选b、d。

 名校课堂系列答案
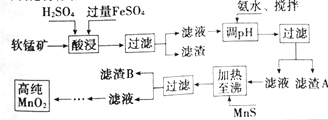
名校课堂系列答案【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。