题目内容
在一定条件下,向密闭容器中加入30mLCO和20mL水蒸气,使其发生反应,当CO(g)+H2O(g) CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的相等,则下列叙述错误的是( )
CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的相等,则下列叙述错误的是( )
A.平衡后CO的体积分数为40% B.平衡后CO的转化率为25%
C.平衡后水蒸气的转化率为50% D.平衡后混合气体的平均相对分子质量为24
【答案】
B
【解析】
试题分析:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 30 20 0 0
转化量(mol) x x x x
平衡量(mol)(30-x) (20—x) x x
达到平衡时,水蒸气的体积分数与H2的相等
则20-x=x
解得x=10
所以平衡后CO的体积分数为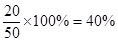
平衡后CO的转化率为
平衡后水蒸气的转化率为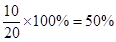
平衡后混合气体的平均相对分子质量为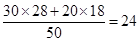
答案选B
考点:考查可逆反应的有关计算
点评:本题是高考中的常见题型,为中等难度的试题,主要是训练学生的逻辑思维能力,以及规范答题能力,提高学生的学习效率。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
|
在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气使其反应,当CO+H2O(g) | |
| [ ] | |
A. |
平衡后水蒸气的体积分数与H2相等 |
B. |
平衡后CO体积与CO2相等 |
C. |
平衡后水的转化率为50% |
D. |
平衡后CO2的体积分数为20% |