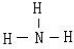��Ŀ����
��ͼ1��ʾ��ת����ϵ�У����ֲ���ʡ�ԣ���A�������ֶ�����Ԫ����ɵ����Σ�H��һ�ּ������������л�ԭ�Ե������D��X���Ӷ���10��������
�Իش��������⣺
��1��A�Ļ�ѧʽΪ ��D���ӵĽṹʽ ��
��2��д������ת����ϵ�����и��ֽⷴӦ�Ļ�ѧ����ʽ��
��3�������£���pH=a��D��ˮ��Һ�м�������pH=b��G��ˮ��Һ����a+b=14����ַ�Ӧ����Һ�и�������Ũ���ɴ�С��˳���� ��
��4����֪��t��ʱ��2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��t��ʱ����һѹǿ�㶨���ܱ������У�����4molH��2molY��Ӧ���ﵽƽ��ų�354KJ����������Y��ת����ԼΪ ���ðٷ�����ʾ����
������ͼ2��ƽ����ϵ�У��ټ���wmol��̬��I���ʣ�t��ʱ�ﵽ�µ�ƽ�⣬��ʱH���ʵ����ʵ���n��H��= mol���������ʽ��
���𰸡����������������Ϣ��H��һ�ּ������������л�ԭ�Ե�����������ѧ�ж�ΪSO2��D��X���Ӷ���10�������ܺͶ�������Ӧ�������ֶ�����Ԫ����ɵ�����A��˵��DX�м��Ե�10���������жϺ���NH3������D��XΪˮ�Ͱ��������AΪ����������泥�ת��ͼ��X�������Ʒ�Ӧ��ȷ��XΪˮ��DΪ����������X+Na2O2��Y+B��D E
E F��H+Y��I�������ж�YΪ������BΪ�������ƣ�����ת����ϵ������ʵ����ʷ����ж�A+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��XΪH2O��DΪSO2������ת����ϵ���������������ж����ʷ���������ݻ�ѧƽ�������ʽ��ʽ�����й�����
F��H+Y��I�������ж�YΪ������BΪ�������ƣ�����ת����ϵ������ʵ����ʷ����ж�A+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��XΪH2O��DΪSO2������ת����ϵ���������������ж����ʷ���������ݻ�ѧƽ�������ʽ��ʽ�����й�����
����⣺����H��һ�ּ������������л�ԭ�Ե�������ͨ������������ʺͻ��ϼۿ�֪�������������м��̬����������Ҳ���Խ��ͣ���ѧ�������ж�HΪ��������D��X���Ӷ���10���������ҺͶ�������Ӧ��������Ԫ����ɵ����Σ�˵��DX���кͶ�������Ӧ�ļ������壬�ƶ�DX���а�������ת����ϵX+Na2O2��Y+B����֪XΪH2O���������ݷ�ӦD+H+X��A��A�������ֶ�����Ԫ����ɵ�����Ϊ��NH4��2SO3������ת����ϵX+Na2O2��Y+B��D E
E F��H+Y��I�������ж�YΪ������BΪNaOH�����ת��ͼ�еĹ�ϵA+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��C+K��H ��SO2����˵��KΪ�ᣬH+Y��I �����ķ�ӦΪSO2+O2��SO3�� I+X��K�����ķ�ӦΪSO3+H2O=H2SO4���ƶ�IΪ��������KΪ����ۺϷ���ת����ϵ��D
F��H+Y��I�������ж�YΪ������BΪNaOH�����ת��ͼ�еĹ�ϵA+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��C+K��H ��SO2����˵��KΪ�ᣬH+Y��I �����ķ�ӦΪSO2+O2��SO3�� I+X��K�����ķ�ӦΪSO3+H2O=H2SO4���ƶ�IΪ��������KΪ����ۺϷ���ת����ϵ��D E
E F
F G���������ķ�ӦΪ��NH3
G���������ķ�ӦΪ��NH3 NO
NO NO2
NO2 HNO3��
HNO3��
��������ת����ϵ�и������ж�Ϊ��A����NH4��2SO3�� B��NaOH�� C��Na2SO3�� D��NH3�� E��NO�� F��NO2�� G��HNO3�� H��SO2�� I��SO3�� K��H2SO4�� X��H2O�� Y��O2��
��1��ͨ�����������ƶ�AΪ����NH4��2SO3��DΪNH3�������ĽṹʽΪ��
�ʴ�Ϊ������NH4��2SO3
��2������ת����ϵ�����ڸ��ֽⷴӦ��ת��Ϊ��A+B��C+D+X��C+K��H����ѧ����ʽΪ����NH4��2SO3+2NaOH Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
�ʴ�Ϊ������NH4��2SO3+2NaOH Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
��3�������£���pH=a��NH3��ˮ��Һ�м�������pH=b��HNO3��ˮ��Һ����a+b=14����ַ�Ӧ����Һ�и�������Ũ���ɴ�С��˳���ǣ�pH=a��NH3��ˮ��Һ��C��OH-��= =10-14+amol/L
=10-14+amol/L
pH=b��HNO3��ˮ��ҺC��H+��=10-bmol/L��a+b=14������C��OH-��=10-14+amol/L=10-bmol/L��C��H+��=C��OH-���������Ϻ�Ӧ��һˮ�ϰ���������Һ�е�����Ũ�ȴ�Сc��NH4+����c��NO3-����c��OH-����c��H+����
�ʴ�Ϊ��c��NH4+����c��NO3-����c��OH-����c��H+��
��4�������ݼ���4molH��2molY��Ӧ���ﵽƽ��ų�354KJ�����������㷴Ӧ�ﵽƽ������ĵ�Y���ʵ���= =1.8mol����ѧƽ�������ʽ������ʽ���㣻
=1.8mol����ѧƽ�������ʽ������ʽ���㣻
2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� 4 2 0
�仯����mol�� 3.6 1.8 3.6
ƽ������mol�� 0.4 0.2 3.6
ƽ���Y��ת����= =90%
=90%
��ѹǿ�㶨���ܱ�������ƽ����ϵ�У��ټ���wmol��̬��I���ʣ�ƽ�������ƶ����¶ȡ�ѹǿ�㶨���ܱ��������൱���ּ���wmolH��0.5wmolY��Ӧ��
��ʼ���������ȣ���ѧƽ���Ч��H �İٷֺ�����ͬ����������ƽ����㣬���ʱת����HΪY��
2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� w 0.5w 0
�仯����mol�� y 0.5y y
ƽ������mol�� w-y 0.5��w-y�� y
��H���= =
=
�õ�Y=0.9W
���Դﵽƽ���H�����ʵ���=0.4mol+w-0.9w=0.4+0.1w��
�ʴ�Ϊ��0.4+0.1w
���������⿼����Ԫ�ػ���������ʱ仯�����ʼ��ת����ϵ������жϳ����������ʽ�������Ũ�ȴ�С���жϣ���ѧƽ��ļ��㣬��Чƽ���Ӧ�ã��ؼ���ץסת����ϵ�е����ۺ�������Ӧ���������е���Ϣ���з����жϸ���Ӧ�������ǽ��������ص㷽���������ۺ���ǿ����Ŀ���ѣ�
 E
E F��H+Y��I�������ж�YΪ������BΪ�������ƣ�����ת����ϵ������ʵ����ʷ����ж�A+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��XΪH2O��DΪSO2������ת����ϵ���������������ж����ʷ���������ݻ�ѧƽ�������ʽ��ʽ�����й�����
F��H+Y��I�������ж�YΪ������BΪ�������ƣ�����ת����ϵ������ʵ����ʷ����ж�A+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��XΪH2O��DΪSO2������ת����ϵ���������������ж����ʷ���������ݻ�ѧƽ�������ʽ��ʽ�����й���������⣺����H��һ�ּ������������л�ԭ�Ե�������ͨ������������ʺͻ��ϼۿ�֪�������������м��̬����������Ҳ���Խ��ͣ���ѧ�������ж�HΪ��������D��X���Ӷ���10���������ҺͶ�������Ӧ��������Ԫ����ɵ����Σ�˵��DX���кͶ�������Ӧ�ļ������壬�ƶ�DX���а�������ת����ϵX+Na2O2��Y+B����֪XΪH2O���������ݷ�ӦD+H+X��A��A�������ֶ�����Ԫ����ɵ�����Ϊ��NH4��2SO3������ת����ϵX+Na2O2��Y+B��D
 E
E F��H+Y��I�������ж�YΪ������BΪNaOH�����ת��ͼ�еĹ�ϵA+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��C+K��H ��SO2����˵��KΪ�ᣬH+Y��I �����ķ�ӦΪSO2+O2��SO3�� I+X��K�����ķ�ӦΪSO3+H2O=H2SO4���ƶ�IΪ��������KΪ����ۺϷ���ת����ϵ��D
F��H+Y��I�������ж�YΪ������BΪNaOH�����ת��ͼ�еĹ�ϵA+B��C+X+D�������ķ�ӦΪ����NH4��2SO3+NaOH��NH3+H2O+Na2SO3���ƶ�CΪNa2SO3��C+K��H ��SO2����˵��KΪ�ᣬH+Y��I �����ķ�ӦΪSO2+O2��SO3�� I+X��K�����ķ�ӦΪSO3+H2O=H2SO4���ƶ�IΪ��������KΪ����ۺϷ���ת����ϵ��D E
E F
F G���������ķ�ӦΪ��NH3
G���������ķ�ӦΪ��NH3 NO
NO NO2
NO2 HNO3��
HNO3����������ת����ϵ�и������ж�Ϊ��A����NH4��2SO3�� B��NaOH�� C��Na2SO3�� D��NH3�� E��NO�� F��NO2�� G��HNO3�� H��SO2�� I��SO3�� K��H2SO4�� X��H2O�� Y��O2��
��1��ͨ�����������ƶ�AΪ����NH4��2SO3��DΪNH3�������ĽṹʽΪ��

�ʴ�Ϊ������NH4��2SO3

��2������ת����ϵ�����ڸ��ֽⷴӦ��ת��Ϊ��A+B��C+D+X��C+K��H����ѧ����ʽΪ����NH4��2SO3+2NaOH
 Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O�ʴ�Ϊ������NH4��2SO3+2NaOH
 Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O
Na2SO3+2NH3��+2H2O��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��3�������£���pH=a��NH3��ˮ��Һ�м�������pH=b��HNO3��ˮ��Һ����a+b=14����ַ�Ӧ����Һ�и�������Ũ���ɴ�С��˳���ǣ�pH=a��NH3��ˮ��Һ��C��OH-��=
 =10-14+amol/L
=10-14+amol/LpH=b��HNO3��ˮ��ҺC��H+��=10-bmol/L��a+b=14������C��OH-��=10-14+amol/L=10-bmol/L��C��H+��=C��OH-���������Ϻ�Ӧ��һˮ�ϰ���������Һ�е�����Ũ�ȴ�Сc��NH4+����c��NO3-����c��OH-����c��H+����
�ʴ�Ϊ��c��NH4+����c��NO3-����c��OH-����c��H+��
��4�������ݼ���4molH��2molY��Ӧ���ﵽƽ��ų�354KJ�����������㷴Ӧ�ﵽƽ������ĵ�Y���ʵ���=
 =1.8mol����ѧƽ�������ʽ������ʽ���㣻
=1.8mol����ѧƽ�������ʽ������ʽ���㣻2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� 4 2 0
�仯����mol�� 3.6 1.8 3.6
ƽ������mol�� 0.4 0.2 3.6
ƽ���Y��ת����=
 =90%
=90%��ѹǿ�㶨���ܱ�������ƽ����ϵ�У��ټ���wmol��̬��I���ʣ�ƽ�������ƶ����¶ȡ�ѹǿ�㶨���ܱ��������൱���ּ���wmolH��0.5wmolY��Ӧ��
��ʼ���������ȣ���ѧƽ���Ч��H �İٷֺ�����ͬ����������ƽ����㣬���ʱת����HΪY��
2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� w 0.5w 0
�仯����mol�� y 0.5y y
ƽ������mol�� w-y 0.5��w-y�� y
��H���=
 =
=
�õ�Y=0.9W
���Դﵽƽ���H�����ʵ���=0.4mol+w-0.9w=0.4+0.1w��
�ʴ�Ϊ��0.4+0.1w
���������⿼����Ԫ�ػ���������ʱ仯�����ʼ��ת����ϵ������жϳ����������ʽ�������Ũ�ȴ�С���жϣ���ѧƽ��ļ��㣬��Чƽ���Ӧ�ã��ؼ���ץסת����ϵ�е����ۺ�������Ӧ���������е���Ϣ���з����жϸ���Ӧ�������ǽ��������ص㷽���������ۺ���ǿ����Ŀ���ѣ�

��ϰ��ϵ�д�
 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
�����Ŀ