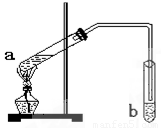
题目内容
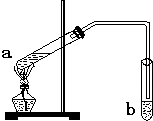 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:(1)写出试管a中发生的化学方程式:
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| 加热 |
(2)试管b中所盛的溶液为
饱和碳酸钠溶液
饱和碳酸钠溶液
,其主要作用是酯在其中的溶解度小,有利于酯的分离
酯在其中的溶解度小,有利于酯的分离
.(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是
防止倒吸
防止倒吸
.(4)该实验中,若用3mol乙醇和1mol乙酸
在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?
不能
不能
(填“能”或“不能”),原因是该反应是可逆反应,反应不能进行到底
该反应是可逆反应,反应不能进行到底
(不考虑原料损耗).分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)导管伸入液面下可能发生倒吸;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)导管伸入液面下可能发生倒吸;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应;
解答:解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;故答案为:饱和碳酸钠溶液;酯在其中的溶解度小,有利于酯的分离;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防止倒吸;
(4)该实验中,若用3mol乙醇和1mol乙酸,在浓硫酸作用下加热,充分反应后,不能生成1mol乙酸乙酯,因为
生成乙酸乙酯的反应是可逆反应,1mol乙酸不能完全变成生成物,故答案为:不能;该反应是可逆反应,反应不能进行到底;
| 浓硫酸 |
| 加热 |
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;故答案为:饱和碳酸钠溶液;酯在其中的溶解度小,有利于酯的分离;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防止倒吸;
(4)该实验中,若用3mol乙醇和1mol乙酸,在浓硫酸作用下加热,充分反应后,不能生成1mol乙酸乙酯,因为
生成乙酸乙酯的反应是可逆反应,1mol乙酸不能完全变成生成物,故答案为:不能;该反应是可逆反应,反应不能进行到底;
点评:本题考查乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目

 ,其主要作用是 。
,其主要作用是 。