题目内容
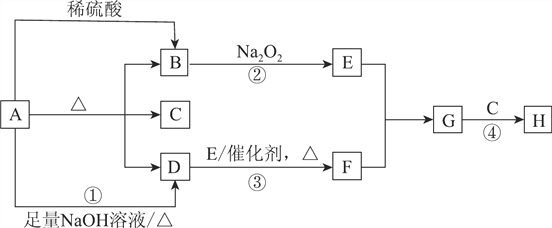
【题目】A~H均是中学常见物质,它们之间有下图所示转化关系(部分产物已略去)。已知:A为酸式盐,常用作化肥;常温下B、D、E、F、G均为气体,C为无色液体。
回答下列问题:
(1)列举工业上D的一种具体用途_______________________。
(2)反应①的离子方程式为______________________________。
(3)在反应②中,若生成1.6gE,则转移电子的物质的量为________mol。
(4)反应③的化学方程式为______________________________。
(5)在反应④中,被氧化的物质与被还原的物质的物质的量之比为________。
【答案】 作制冷剂、生产氮肥、生产硝酸等 NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O 0.1 4NH3+5O2
NH3↑+CO32-+2H2O 0.1 4NH3+5O2![]() 4NO+6H2O 2︰1
4NO+6H2O 2︰1
【解析】因为A为酸式盐,常用作化肥,既能和硫酸反应又能和氢氧化钠反应且均生成气体,结合其受热分解生成两种气体和一种液体,所以可以确定A为碳酸氢铵,B为二氧化碳,C为水,D为氨气。二氧化碳与过氧化钠反应生成氧气,所以E为氧气。氨气经催化氧化为一氧化氮,所以F为NO。NO和氧气反应生成二氧化氮,所以G为二氧化氮。二氧化氮和水反应生成硝酸和NO,所以H为硝酸。
(1)工业上氨气具体用途是作制冷剂、生产氮肥、生产硝酸等。
(2)反应①的离子方程式为NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O。
NH3↑+CO32-+2H2O。
(3)在反应②中,生成一个氧气分子,电子转移的数目是2e-,所以若生成1.6g氧气,则转移电子的物质的量为0.1mol。
(4)反应③的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(5)在反应④的化学方程式为3NO2+H2O=2HNO3+NO,被氧化的物质是二氧化氮,产物是硝酸;被还原的物质也是二氧化氮,产物为NO,所以被氧化的物质与被还原的物质的的物质的量之比为2︰1。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案