题目内容
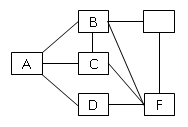
(8分)防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放。有一种工业废水,已知其中含有大量的Fe2+和SO42-,少量的Ag+ 以及部分污泥。某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水。

根据上述操作过程,回答下列问题:
(1)在实验室进行①操作时,需要的主要玻璃仪器有 。(2)操作②的名称是 。
(3)向溶液A中需要加入过量X,X是 ,发生反应的离子方程式为 。
(4)上述操作回收到的物质是 。

根据上述操作过程,回答下列问题:
|
(3)向溶液A中需要加入过量X,X是 ,发生反应的离子方程式为 。
(4)上述操作回收到的物质是 。
(8分)(1)漏斗烧杯玻璃棒 (2)蒸发结晶
(3)Fe Fe+2Ag+=Fe2++2Ag (4)银和硫酸亚铁晶体
(3)Fe Fe+2Ag+=Fe2++2Ag (4)银和硫酸亚铁晶体
试题分析:(1)操作①是过滤,需要的主要玻璃仪器有漏斗、烧杯、玻璃棒。
(2)溶质从溶液中析出,需要蒸发结晶。
(3)要回收单质银,且不能在引入杂质,则X应该是铁,发生反应的离子方程式是Fe+2Ag+=Fe2++2Ag。
(4)根据转化图可知,固体B是银,晶体是硫酸亚铁晶体
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
 或HCO
或HCO
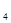 ,振荡、静置
,振荡、静置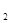 溶液
溶液