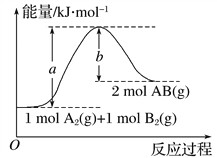
题目内容
【题目】 把盛有NO2和N2的混合气体的试管倒立在盛水的水槽中,最终液面上升到距试管底部2/3处,则原混合气体中NO2和N2的体积比是
A.1∶1B.1∶2C.2∶1D.3∶1
【答案】A
【解析】
试题分析:3NO2+H2O=2HNO3+NO,由题意可知气体体积缩小了1/3,所以NO2的体积为1/2体积,N2为1/2体积,则原混合气体中NO2和N2的体积比是1∶1。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好)。请回答:
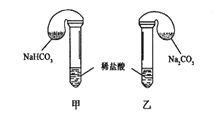
(1)各组反应开始时,____________(甲、乙)装置中的气球体积先变大,该装置中反应的化学反应方程式是_____________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。
试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
第①组 | 0.42gNaHCO3 0.53gNa2CO3 3mL 4mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
第②组 | 0.3gNaHCO3 0.3gNa2CO3 3mL 4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | A:___________ |
第③组 | 0.6gNaHCO3 0.6gNa2CO3 3mL 2 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | B:______________ |
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用化学方程式表示) C:___________ |
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是( )
选项 | 现象 | 解释 |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
A. A B. B C. C D. D