题目内容
【题目】尿素(NH2CONH2)是目前含氮量最高的氮肥。国内外主要以NH3和CO2为原料进行合成。主要通过以下二个反应进行:
第一步:2NH3(l)+CO2(g)![]() H2NCOONH4(l) △H1=-117.2kJ·mol-1
H2NCOONH4(l) △H1=-117.2kJ·mol-1
第二步:H2NCOONH4(l)![]() H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
请回答:
(1)己知:NH3(l)![]() NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)
NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)![]() 2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
(2)①一定条件下,n(NH3)/n(CO2)对NH2COONH4的平衡转化率会产生明显的影响,如图1所示。NH2COONH4的平衡转化率随n(NH3)/n(CO2)增大而上升,试分析其原因:_______________。

②恒温密闭容器中,一定量的NH3和CO2反应合成尿素,第10 min达到平衡。若相同条件下反应1的速率要快于反应2,请在图中画出0~15min内,NH2COONH4的物质的量浓度随时间变化曲线____________。

③下图表示不同条件下,反应:N2(g) +3H2(g)![]() 2NH3(g)的产物浓度随时间的变化曲线。
2NH3(g)的产物浓度随时间的变化曲线。
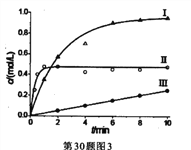
下列有关说法中,正确的是____________。
A.达到平衡时间最快的是II
B.反应约10分钟后,三个反应均己达到平衡
C.I条件下氢气的平衡转化率大于Ⅱ
D.三个反应的平衡常数一定相同
(3)用电化学方法可以实现低温常压合成氨。下图是以含N3-熔融盐为电解质,电解合成氨装置的工作原理示意图。阴极的电极反应是_______________________。

【答案】 95.5+2c 该反应是熵增反应,有利于正向进行 过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升 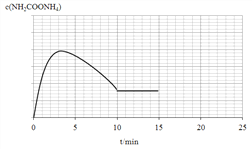 A N2+6e-=2N3-
A N2+6e-=2N3-
【解析】(1)考查热化学反应方程式的计算以及化学反应进行方向的判断,①2NH3(l)+CO2(g) ![]() H2NCOONH4(l),②H2NCOONH4(l)
H2NCOONH4(l),②H2NCOONH4(l) ![]() H2O(l)+H2NCONH2(l),③NH3(l)
H2O(l)+H2NCONH2(l),③NH3(l)![]() NH3(g),根据盖斯定律的计算,2×③-(①+②)得出:△H3=(95.5+2c)kJ·mol-1;此反应是熵增反应,有利于反应正向进行;(2)本题考查勒夏特列原理的应用, ①过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升;②相同条件下,反应1的速率快于反应2,因此生成H2NCOONH4曲线比消耗H2NCOONH4曲线陡,在10min时达到平衡,即10min到15min应是平行x轴的直线,即图像是
NH3(g),根据盖斯定律的计算,2×③-(①+②)得出:△H3=(95.5+2c)kJ·mol-1;此反应是熵增反应,有利于反应正向进行;(2)本题考查勒夏特列原理的应用, ①过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升;②相同条件下,反应1的速率快于反应2,因此生成H2NCOONH4曲线比消耗H2NCOONH4曲线陡,在10min时达到平衡,即10min到15min应是平行x轴的直线,即图像是 ;③A、根据图像,II首先达到平衡,即II的反应速率最快,首先达到平衡,故A正确;B、反应到10min,II和III达到平衡,I不知道10min后曲线,因此无法判断I是否达到平衡,故B错误;C、题目中没有说明改变的条件,如果I改变的条件是通入H2,虽然平衡向正反应方向进行,但氢气的转化率降低,如果II是增大压强,平衡向正反应方向进行,氢气的转化率增大,故C错误;D、如果II是升高温度,反应速率加快,但化学平衡常数降低,II通入氢气,温度不变,平衡常数不变,则两者平衡常数不相同,故D错误;(3)考查电解原理以及电极反应式的书写,根据装置图电子移动方向,电子从电源的负极出发流向阴极,从阳极流向电源的正极,通N2的一极为阴极,通氢气的一极为阳极,阴极电极反应式为N2+6e-=2N3-。
;③A、根据图像,II首先达到平衡,即II的反应速率最快,首先达到平衡,故A正确;B、反应到10min,II和III达到平衡,I不知道10min后曲线,因此无法判断I是否达到平衡,故B错误;C、题目中没有说明改变的条件,如果I改变的条件是通入H2,虽然平衡向正反应方向进行,但氢气的转化率降低,如果II是增大压强,平衡向正反应方向进行,氢气的转化率增大,故C错误;D、如果II是升高温度,反应速率加快,但化学平衡常数降低,II通入氢气,温度不变,平衡常数不变,则两者平衡常数不相同,故D错误;(3)考查电解原理以及电极反应式的书写,根据装置图电子移动方向,电子从电源的负极出发流向阴极,从阳极流向电源的正极,通N2的一极为阴极,通氢气的一极为阳极,阴极电极反应式为N2+6e-=2N3-。