题目内容
2008年北京奥运会火炬采用了丙烷作燃料,充分燃烧后只生成CO2和H2O,对环境污染极小,体现了绿色奥运的精神.已知1g丙烷完全燃烧生成CO2和液态水,放出50.405kJ热量,则下列热化学方程式正确的是( )
分析:根据1g丙烷完全燃烧生成CO2和液态水,放出50.405kJ热量,可计算出1mol丙烷燃烧放出的热量,同时注意生成的必须是液态水.
解答:解:1g丙烷完全燃烧生成CO2和液态水,放出50.405kJ热量,可知1mol丙烷燃烧放出的热量为Q=50.405kJ×44═2217.82 kJ.
A、反应热△H的数值不对,应为△H=-2217.82 kJ?mol-1.故A错误.
B、反应热△H的正负不对.因为反应放热,反应热△H应为负值,即△H=-2217.82 kJ?mol-1.故B错误..
C、反应热△H的数值不对,应为△H=-2217.82 kJ?mol-1.故C错误.
D、因为反应放热,反应热△H应为负值,即△H=-2217.82 kJ?mol-1.故D正确.
答案:D
A、反应热△H的数值不对,应为△H=-2217.82 kJ?mol-1.故A错误.
B、反应热△H的正负不对.因为反应放热,反应热△H应为负值,即△H=-2217.82 kJ?mol-1.故B错误..
C、反应热△H的数值不对,应为△H=-2217.82 kJ?mol-1.故C错误.
D、因为反应放热,反应热△H应为负值,即△H=-2217.82 kJ?mol-1.故D正确.
答案:D
点评:此题考查了热化学方程式的书写,属于比较基础的题目,难度不大.

练习册系列答案
相关题目
2008 年北京奥运会主体育场的外形好似“鸟巢”( The Bird Nest ).有一类硼烷也好似鸟巢,故称为巢式硼烷.巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化.如图是三种巢式硼烷,有关说法正确的是( )

| A、这类巢式硼烷的通式是 CnHn+4 | ||||
B、2B5H9+12O2
| ||||
| C、8 个硼原子的巢式棚烷化学式应为 B8H10 | ||||
| D、硼烷与水反应是非氧化还原反应 |
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍,工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓、氮化铟这些高亮度LED材料.有关说法正确的是( )
| A、合金的熔点通常比组分金属高,硬度比组分金属小 | B、已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2 | C、用金属铝与V2O5冶炼钒,铝作氧化剂 | D、ETFE膜(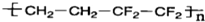 )是由两种单体加聚而成的 )是由两种单体加聚而成的 |
为把2008年北京奥运会办成真正的“绿色奥运”,减少温室气体的排放,你认为下列能源中最适宜作为城市交通燃料的是( )
| A、汽油 | B、乙醇 | C、氢气 | D、天然气 |