题目内容
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是

A.实验①、②所涉及的物质均为电解质
B.实验②、③均为放热反应
C.实验②、③均未发生氧化还原反应
D.实验①、③反应制得的物质均为纯净物
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是_________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)能说明反应Ⅱ已经达到平衡状态的是_____________。
A.混合气体的平均相对分子质量不变
B.混合气体的密度不变
C.v(H2)正>v(CO)正
D.n(CO)/n(H2)不变
(4)在恒容密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
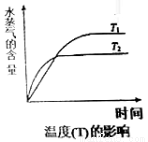
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应压力平衡常数KP为____________(用P0表示,并化简)。




 )混合液中H2SO4、HNO3的物质的量浓度各是多少?
)混合液中H2SO4、HNO3的物质的量浓度各是多少? 有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体。关于烧杯中物质组成的说法正确的是 ( )
有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体。关于烧杯中物质组成的说法正确的是 ( )