ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΘ®1Θ©Α±ΤχΨΏ”–ΜΙ‘≠–‘,‘ΎΆ≠ΒΡ¥ΏΜ·Ής”Οœ¬, Α±ΤχΚΆΖζΤχΖΔ…ζΖ¥”Π…ζ≥…AΚΆBΓΘAΈΣοß―Έ,B‘Ύ±ξΉΦΉ¥Ωωœ¬ΈΣΤχΧ§ΓΘ‘Ύ¥ΥΖ¥”Π÷–,»τ”–1ΧεΜΐΑ±Τχ≤ΈΦ”Ζ¥”Π,‘ρ”–0.75ΧεΜΐΖζΤχ≤ΈΦ”Ζ¥”Π;»τ”–8.96 LΑ±Τχ(±ξΉΦΉ¥Ωω)≤ΈΦ”Ζ¥”Π,‘ρ…ζ≥…0.3 mol AΓΘ‘Ύ±ξΉΦΉ¥Ωωœ¬,…ζ≥…2.24 L B,‘ρΗΟΖ¥”Π÷–ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ molΓΘ
Θ®2Θ©ΫΪΒ»Έο÷ ΒΡΝΩFe2O3”κFeCl3÷Ο”ΎΟή±’Ιή÷–Φ”»»Θ§Ρή«ΓΚΟΆξ»ΪΖ¥”ΠΘ§«“÷Μ…ζ≥…“Μ÷÷≤ζΈοXΘ§ΤδΈο÷ ΒΡΝΩ «Ζ¥”ΠΈοΉήΈο÷ ΒΡΝΩΒΡ1.5±ΕΘ§–¥≥ωXΒΡΜ·―ß Ϋ ΘΜ
Θ®3Θ©Άξ≥…“‘œ¬―θΜ·ΜΙ‘≠Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ
( )MnO4Θ≠+ SO32Θ≠+ = Mn2++ SO42Θ≠+
ΓΨ¥πΑΗΓΩΘ®1Θ© 0.6Θ®2Θ© FeOClΘΜ
Θ®3Θ© 2 5 6H+ 2 5 3H2O
ΓΨΫβΈωΓΩ
‘ΧβΖ÷ΈωΘΚΘ®1Θ©ΗυΨίΧβ“β÷ΣNH3”κF2Ζ¥”ΠΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ0.75=4ΓΟ3Θ§οß―ΈAΈΣNH4FΘ§ΗυΨί‘≠Ή” ΊΚψΆΤ≥ωBΈΣ NF3Θ§‘ρΜ·―ßΖΫ≥Χ ΫΈΣ4NH3+3F2![]() 3NH4F+NF3Θ§¥”Μ·―ßΖΫ≥Χ ΫΩ…÷ΣΘ§…ζ≥…0.1 mol NF3Θ§ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ0.6 molΓΘ
3NH4F+NF3Θ§¥”Μ·―ßΖΫ≥Χ ΫΩ…÷ΣΘ§…ζ≥…0.1 mol NF3Θ§ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ0.6 molΓΘ
Θ®2Θ©ΫΪΒ»Έο÷ ΒΡΝΩFe2O3”κFeCl3÷Ο”ΎΟή±’Ιή÷–Φ”»»Θ§Ρή«ΓΚΟΆξ»ΪΖ¥”ΠΘ§«“÷Μ…ζ≥…“Μ÷÷≤ζΈοXΘ§ΤδΈο÷ ΒΡΝΩ «Ζ¥”ΠΈοΉήΈο÷ ΒΡΝΩΒΡ1.5±ΕΘ§…ηFe2O3”κFeCl3Έο÷ ΒΡΝΩΕΦ «1molΘ§‘ρ…ζ≥…XΈο÷ ΒΡΝΩΈΣ3molΘ§Φ¥Fe2O3+FeCl3ΘΫ3XΘ§“άΨί‘≠Ή” ΊΚψΒΟΘΚXΒΡΜ·―ß ΫΈΣΘΚFeOClΘΜ
Θ®3Θ©ΗΟΖ¥”Π÷–S‘ΣΥΊ”…+4±δΈΣ+6Θ§…ΐΗΏ2ΦέΘ§Mn‘ΣΥΊ”…+7±δΈΣ+2Θ§ΫΒΒΆ5ΦέΘ§ΗυΨίΜ·ΚœΦέ…ΐΫΒ ΊΚψΩ…÷ΣSO32Θ≠ΓΔSO42Θ≠ΒΡΜ·―ßΦΤΝΩ ΐΈΣ5Θ§MnO4Θ≠ΓΔMn2+ΒΡΜ·―ßΦΤΝΩ ΐΈΣ2Θ§”…―θ‘≠Ή” ΊΚψΩ…÷ΣΘΚ…ζ≥…Έο»±3molH2OΘ§ΗυΨίΒγΚ… ΊΚψ ΊΚψΩ…÷ΣΘΚΖ¥”ΠΈο÷–»±6molH+Θ§Ι ΗΟΜ·―ßΖΫ≥Χ ΫΈΣ2 MnO4Θ≠+5SO32Θ≠+6H+ΘΫ2Mn2++5SO42Θ≠+3H2OΓΘ

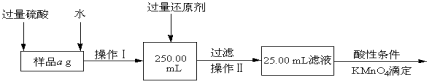
 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΙΛ“Β…œœϊ≥ΐΒΣ―θΜ·ΈοΒΡΈέ»ΨΘ§Ω…”Ο»γœ¬Ζ¥”ΠΘΚCH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)ΓςH=a kJ/molΘΜ‘ΎΈ¬Ε»T1ΚΆT2 ±Θ§Ζ÷±πΫΪ0.50molCH4ΚΆ1.2molNO2≥δ»κΧεΜΐΈΣ1LΒΡΟή±’»ίΤς÷–Θ§≤βΒΟn(CH4)Υφ ±Φδ±δΜ· ΐΨί»γœ¬±μΘΚ
Έ¬Ε» | ±Φδ/min/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | Γ≠ | 0.15 |
œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
AΘ°10minΡΎΘ§![]() ±CH4ΒΡΜ·―ßΖ¥”ΠΥΌ¬ ±»T2 ±–Γ
±CH4ΒΡΜ·―ßΖ¥”ΠΥΌ¬ ±»T2 ±–Γ
BΘ°T1ΘΦT2
CΘ°ΤΫΚβ≥Θ ΐΘΚK(T1)ΘΦK(T2)
DΘ°aΘΦ0
ΓΨΧβΡΩΓΩ“―÷Σ““»©Θ®CH3CHOΘ©ΚΆ–¬÷Τ«β―θΜ·Ά≠ΒΡΖ¥”Π»γœ¬ΘΚ
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2OΓΐ+3H2O
CH3COONa+Cu2OΓΐ+3H2O
Ρ≥ Β―ι–ΓΉιΉω…œ ωΖ¥”Π ±Θ§ΖΔœ÷NaOHΒΡ”ΟΝΩΕ‘Ζ¥”Π≤ζΈο”–”ΑœλΘ§”Ύ «ΥϊΟ«≤…”ΟΩΊ÷Τ±δΝΩΒΡΖΫΖ®Θ§Ψυ Ι”Ο0.5 mL 40%ΒΡ““»©»ή“ΚΫχ––œ¬Ν– Β―ιΓΘ
±ύΚ≈ | 2%CuSO4»ή“ΚΒΡΧεΜΐ | 10%NaOH»ή“ΚΒΡΧεΜΐ | ’ώΒ¥Κσ | pH | Φ”““»©Υ°‘ΓΦ”»»ΚσΒΡ≥ΝΒμ―’…Ϊ |
1 | 2 mL | 3ΒΈ | «≥άΕ¬Χ…Ϊ≥ΝΒμ | 5~6 | «≥άΕ¬Χ…Ϊ≥ΝΒμ |
2 | a | 15ΒΈ | «≥άΕ…Ϊ≥ΝΒμ | 7~8 | ΚΎ…Ϊ≥ΝΒμ |
3 | 1 mL | 1 mL | άΕ…Ϊ–ϋΉ«≥ΝΒμΫœ…Ό | 9~10 | ΚλΚ÷…Ϊ≥ΝΒμ |
4 | b | 2 mL | άΕ…Ϊ–ϋΉ«≥ΝΒμΫœΕύ | 11~12 | Κλ…Ϊ≥ΝΒμ |
5 | 1 mL | 3 mL | άΕΉœ…Ϊ»ή“Κ | 12~13 | ΓΣΓΣΓΣΓΣ |
Θ®1Θ©…œ±μ÷–aΓΔb”ΠΈΣ Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
AȰ15¸ȧ1 mL BȰ2 mLȧ1 mL CȰ15¸ȧ2 mL DȰ2 mLȧ2 mL
Θ®2Θ©≤ι‘ΡΉ ΝœΩ…÷ΣΘ§ Β―ι1÷–ΒΡ«≥άΕ¬Χ…Ϊ≥ΝΒμ÷ς“Σ≥…ΖίΈΣCu2(OH)2SO4Θ§ ή»»≤Μ“ΉΖ÷ΫβΓΘ–¥≥ω…ζ≥…Cu2(OH)2SO4Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ ΓΘΜυ”Ύ Β―ι1ΓΔ2ΒΡœ÷œσΩ…“‘ΒΟ≥ωΫα¬έΘΚNaOH”ΟΝΩΫœ…Ό ±Θ§ ΓΘ
Θ®3Θ©–ΓΉιΆ§―ßΆΤ≤β Β―ι3÷–ΒΡΚλΚ÷…Ϊ≥ΝΒμΩ…Ρή «CuOΚΆCu2OΒΡΜλΚœΈοΘ§Τδάμ¬έ“άΨί « ΓΘ
Θ®4Θ©ΈΣΝΥΫχ“Μ≤Ϋ÷ΛΟς Β―ι4÷–Κλ…Ϊ≥ΝΒμΒΡ≥…Ζ÷Θ§ΗΟ–ΓΉιΆ§―ß≤ι‘ΡΉ ΝœΒΟ÷ΣΘΚCu2O‘ΎΦν–‘ΧθΦΰœ¬Έ»Ε®Θ§‘ΎΥα–‘»ή“Κ÷–Ω…ΉΣΜ·ΈΣCu2+ΓΔCuΓΘ≤ΔΫχ––ΝΥ“‘œ¬ Β―ιΓΘ
ΔΓΘ°ΫΪ Β―ι4Ζ¥”ΠΚσΒΡ ‘ΙήΨ≤÷ΟΘ§”ΟΫΚΆΖΒΈΙήΈϋ≥ω…œ≤ψ«ε“ΚΓΘ
ΔΔΘ°œρœ¬≤ψΉ«“Κ÷–Φ”»κΙΐΝΩœΓΝρΥαΘ§≥δΖ÷’ώΒ¥ΓΔΦ”»»Θ§”ΠΙέ≤λΒΫΒΡœ÷œσ « ΓΘ
Θ®5Θ©–ΓΉιΆ§―ßΦΧ–χ≤ι‘ΡΉ ΝœΒΟ÷ΣΘΚCu(OH)2Ω…”κOH-ΦΧ–χΖ¥”Π…ζ≥…άΕΉœ…Ϊ»ή“ΚΘ®[Cu(OH)4] 2-Θ©Θ§”…¥ΥΧα≥ωΈ ΧβΘΚ[Cu(OH)4] 2-ΡήΖώ”κ““»©ΖΔ…ζΖ¥”ΠΘ§…ζ≥…Κλ…Ϊ≥ΝΒμΘΩ…ηΦΤ Β―ιΫβΨω’β“ΜΈ ΧβΘ§ΚœάμΒΡ Β―ι≤Ϋ÷η « ΓΘΜυ”Ύ…œ ω Β―ιΘ§ΗΟ–ΓΉιΆ§―ßΜώΒΟΫα¬έΘΚ““»©≤Έ”κΖ¥”Π…ζ≥…Κλ…Ϊ≥ΝΒμ ±Θ§–ηΩΊ÷ΤΧεœΒΒΡpH>10ΓΘ