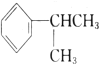
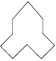
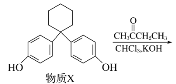
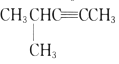��Ŀ����
����Ŀ���й���ѧ����պī֭��д���ֽ����Ϊ�����缫,��Ʋ���װ�����͡����ԡ����۵��Ŀɳ��﮿������������ͼ����صĹ���ԭ��������ͼ�������й�˵����ȷ����
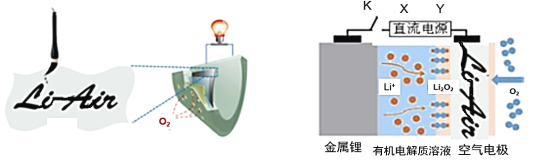
A. �ŵ�ʱ��ֽ���е���ά����Ϊ﮵�صĸ���
B. ���ʱ���������ų�1 mol O2������4 mol e-�ص���Դ����
C. ����K�պϸ�﮵�س�磬XΪֱ����Դ����
D. �ŵ�ʱ��Li+�����������л��������Һ����
���𰸡�C
��������
A.��ά�ز����磬ʯī���磬�ʷŵ�ʱ��ֽ�ű���ë����д�����µ�ʯī�����������A����B.���ʱΪ�������������ų�1 mol O2,��ʧȥ4 mol e-��������4mole-����B������C.���ʱ��ֱ����Դ�������ظ���(�����)��������XΪֱ����Դ������C��ȷ��D.ԭ��ػ���ع���ʱ������������������ӵ��ƶ�����һ����ѭ������������ԭ��ԭ�طŵ�ʱ��������е�Li+������������D���𰸣�C��

����Ŀ��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ�����ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�
��1������ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)+5O2(g)��4NO(g)+6H2O(l) ��H1
��4NH3(g)+6NO(g)��5N2(g)+6H2O(l) ��H2
��4NH3(g)+3O2(g)��2N2(g)+6H2O(l)�Ħ�H��_____��(���ú��Ц�H1����H2��ʽ�ӱ�ʾ)
��2����������ֱ������ȼ�ϵ�أ�ѡ�������Һ��Ϊ�������Һ��д�������ĵ缫��Ӧʽ__________��
��3����֪�ϳɰ���Ӧ�ķ���ʽΪN2+3H2![]() 2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
�����ϱ����ݿ�֪�÷�Ӧ��H______0(�>����<��)��
��400��ʱ�����ijʱ��c(N2)��1 mol��L-1��c(H2)��3 mol��L-1��c(NH3)��2 mol��L-1����ʱ�̸÷�Ӧ��v��____v��(����>����=������<��)��
��4����ͼ���ܱշ�Ӧ���а�n(N2)��n(H2)��1��3Ͷ�Ϻ�ϳ�NH3����200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�

������a��Ӧ���¶���__________________��
�ڹ��ںϳɰ��ķ�Ӧ������������ȷ����________��
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ͼ��M��Q��ƽ�ⳣ��K�Ĺ�ϵ��K(M)>K(Q)
��M���Ӧ��H2��ת������____________________��
��400��ʱ����1mol N2��3mol H2�����ѹ�ܱ������У���ͼ�ֱ�����ʱ�(��H)���������ƽ����Է�������(M)��N2��������[��(N2)]�ͻ�������ܶ�(��)�뷴Ӧʱ�䣨t���Ĺ�ϵ����ͼ��ȷ���ܱ����÷�Ӧ�ﵽƽ��״̬����_____________________��