题目内容
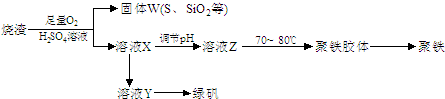
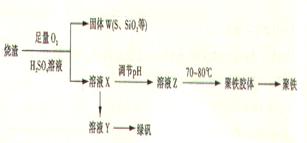
(15分)聚合硫酸铁又称聚铁,化学式为,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
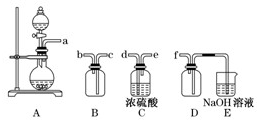
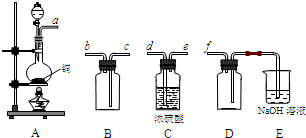
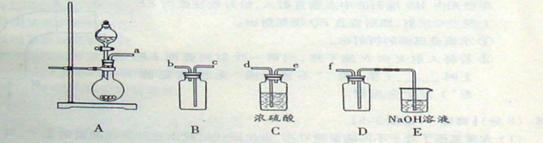
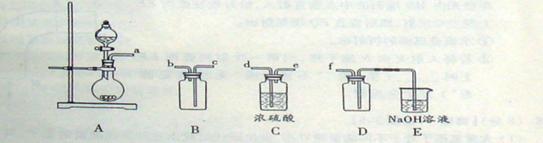
(1)验证固体W焙烧后产生的气体含有SO2 的方法是___。
(2)制备绿矾时,向溶液X中加入过量___,充分反应后,经_____操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为____。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:
。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料____________________kg。
(1)将气体通入品红溶液中,如品红褪色,加热后又变红,注明有二氧化硫。
(2)铁粉 过滤
(3)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后根标准比色卡对比 低
(4)2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4
(5)4000
解析:(1)二氧化硫具有漂泊性可以使品红溶液褪色,但其漂白不是很稳定,加热后又可恢复原来颜色。
(2)溶液X中含有Fe3+,必须除去,但又不能引入新的杂质,可选用铁粉,过量的铁粉通过过滤除去.
(3)检验溶液的pH值是一定不能先润湿pH试纸,也不能插入到溶液中,正确的方法是将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后根标准比色卡对比。若溶液Z的pH偏小,说明酸性较强,会是的聚铁中氢氧根偏少,硫酸根偏多,因而铁的质量分数偏低。
(4)依据题意可得该反应属于氧化还原反应,有二氧化硫生成,方程式为
2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O、SO3+H2O=H2SO4。
(5)根据方程式可计算需要氢氧化钠的物质的量是![]() 40000mol,由原子守恒知硫酸钠的物质的量是20000mol。所以最终生成的硫酸铁中的SO42-来自最后加入的绿矾,最后加入的绿矾是
40000mol,由原子守恒知硫酸钠的物质的量是20000mol。所以最终生成的硫酸铁中的SO42-来自最后加入的绿矾,最后加入的绿矾是![]() 60000mol,生成硫酸铁20000mol。总的铁原子是
60000mol,生成硫酸铁20000mol。总的铁原子是![]() 90000mol,由铁原子守恒知Fe2O3的量是
90000mol,由铁原子守恒知Fe2O3的量是
 ,质量是4000kg。
,质量是4000kg。

 步步高达标卷系列答案
步步高达标卷系列答案